80 年代以后,隨著基因組學、蛋白質組學、等分子生物學科的完善,以靶點為核心的藥物研發模式逐漸建立。當新的基因或蛋白質的功能被揭示之后,其分子生物學機制得到明確,就可以尋找該生物效應傳導機制上的相關環節作為靶點,如受體常在生理效應中發揮信號轉導的作用,針對其可以研發激動劑或拮抗劑,以激活或抑制相應的生理活動。
苗頭化合物評價標準。以上方法篩選出的化合物并不一定都適合作為苗頭化合物,苗頭化合物應基本滿足如下的標準:1)與靶標的結合強度不低于 10μmol/L;2)有一定水溶性,溶解度不低于 10μg/mL;3)可穿越細胞膜;4)細胞水平顯示生物活性;5)無細胞毒作用;6)具有化學穩定性;7)可以制備獲得;8)具有知識產權的保護3。此外 Lipinski也根據大量臨床口服藥物的化學結構,歸納出一些經驗性特征成為遴選苗頭化合物、先導化合物和構建化合物庫的重要參考標準,即口服藥物的類藥 5 原則:1)相對分子質量低于 500;2)氫鍵給體低于 5;3)氫鍵接受體低于 10;4)clogP(脂水分配系數)低于5。
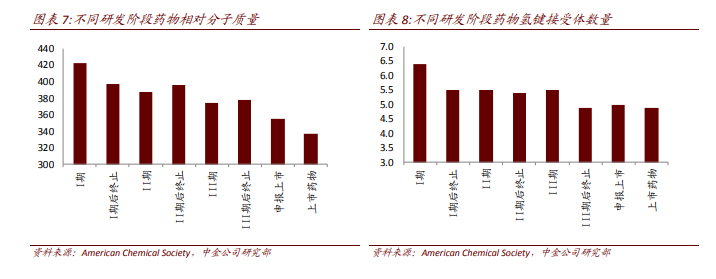
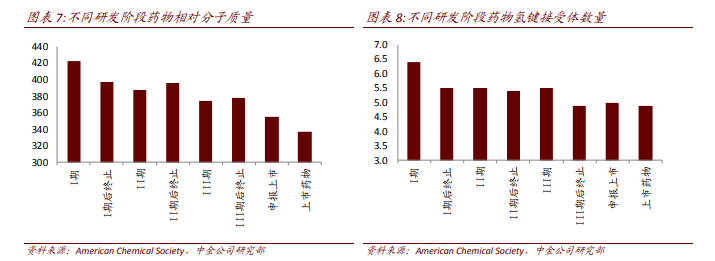
活性不是苗頭、先導化合物的唯一評價標準。篩選苗頭化合物、先導化合物不能僅以活性強度作為單一指標而忽視其他因素。但相對分子質量、親脂性、水溶解性等是影響藥物藥代的重要因素,忽視這些因素易導致后續開發遇到難題,例如在苗頭化合物的后續優化中人們往往加入基團或者片段,以增加與靶點結合的機會,提高活性強度,但相對分子質量過大會導致藥物不易吸收、過膜性差、部分基團容易被代謝等。Wenlock 對不同研發階段藥物的相對分子質量進行了統計,上市藥物的相對分子質量要明顯低于在研藥物,氫鍵接受體也有類似的現象。