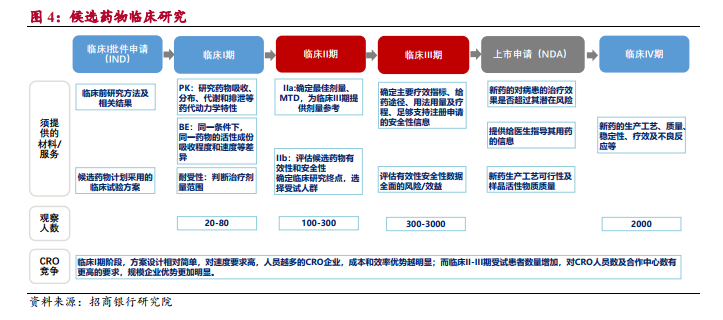
化合物研究是新藥研發初始階段,為創新藥研發提供初始藥物分子結構。化合物研究按照時間先后順序劃分為靶標選擇與證實、先導化合物研究及優化、早期安全測試等。其中,靶標指藥物相互作用發揮治療效果的細胞結構,包括蛋白酶、受體、離子通道等,能和靶標結合的藥物分子即為“先導化合物”。臨床前 CRO 企業研究確定藥物靶標與疾病相關性后,即可通過結構模擬等設計與靶標結合的藥物分子結構。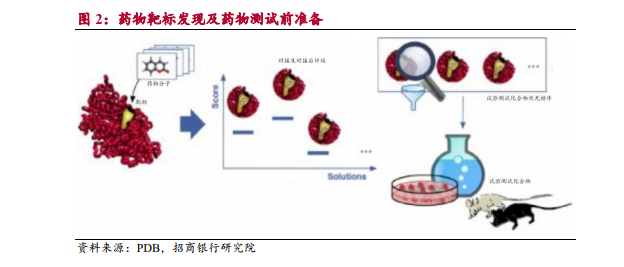
藥物臨床前試驗為藥物提供安全性、藥物毒理等評估。臨床前試驗包括藥代動力學、藥理毒理、動物模型構建等。這一階段主要在實驗室條件下,對先導化合物進行實驗室研究和活體動物研究,以觀察其對目標疾病的生物活性,并進行安全性評估。臨床前外包也包括化學合成外包,在這個階段,企業開始研究如何生產臨床試驗所需的大量藥品,包括藥物的合成工藝、分離提純、劑型選擇、處方篩選、檢驗方法等內容。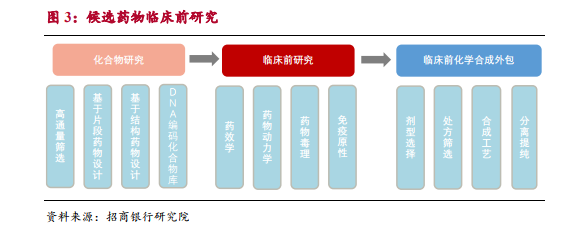
不同臨床階段試驗標準和受試人群數量存在較大差異。IND 審核主要關注候選藥物化學結構及其作用機理、副作用、生產工藝和穩定性等。臨床 I 期通過試驗,評估候選藥物在人體的藥理學及安全性。這一階段通常需要 20-30 例受試者,規模較小。到臨床 II 期驗證藥物治療作用和安全性階段,受試人群增加到幾十至幾百人不等,規模擴大,對研發機構臨床招募能力提出較高要求。臨床 III 期階段,主要關注藥物用法用量及風險收益比,這一階段臨床受試人群擴展到幾百到數千人。完成臨床 III 期后即進入 NDA 階段,藥品上市后仍會進行臨床 IV 期考察在廣泛使用條件下的藥物療效和不良反應。