政策環境顯著改善。近幾年醫藥行業的政策方向是來自國家頂層設計,從政策的頒布機構來看,無論是2015年8月《關于改革藥品醫療器械審評審批制度的意見》、2016年3月《關于開展仿制藥質量與療效一致性評價的意見》,還是2017年10月的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,都是中辦、國辦(國務院)等機構發布,政策方向已得到國家層面的高度認可。我國已經加入了ICH,并當選為ICH管理委員會成員。作為監管成員,我國需要在幾年內完全實施ICH二級指導原則,這是加入ICH對我國藥監系統提出的必然要求。這雖然仍有較長的路要走,但我國藥政體系更加國際化、監管標準愈發趨嚴的趨勢預計不會改變。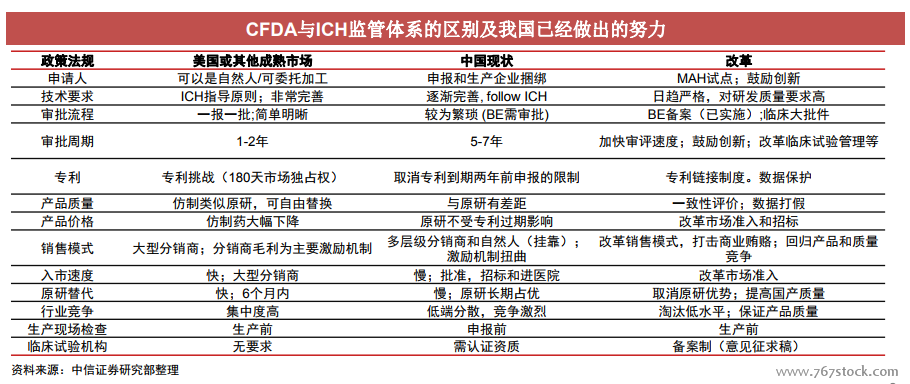
藥企研發積極性持續提升。臨床試驗申請上,2018年CDE收到國產新藥臨床試驗申請218個,較2017年增加35個。研發支出上,2017年研發支出排名前20的制藥企業平均研發支出同比+44.4%,其中復星醫藥、石藥集團2018H1研發費用分別達11.9億(+89.8%)和5.8億元(+106.4%),恒瑞醫藥2018年報披露研發投入達到26.7億元,同比增幅51.8%,研發費用率達15.33%。近期復宏漢霖的利妥昔單抗(HLX01)、樂普醫療NeoVas完全可降解支架陸續獲批,對于創新藥、創新醫療器械的審批速度并未放緩,鼓勵創新、推動產業升級依然是長期趨勢。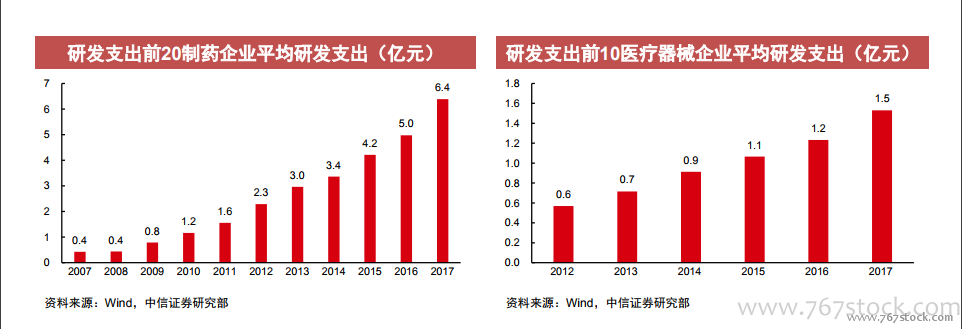
科創板有望助力國內醫藥融資熱情。根據CVSource的數據,2018年國內醫藥融資總額139億美元,同比增加79%,其中創新藥融資41億美元,同比增加209%。從融資結構上看,2018年國內生物醫藥融資占總融資23%,低于全球平均44%的水平,仍有較大提升空間。從科創板的上市標準上看,第五條特別提到了“醫藥行業企業需至少有一項核心產品獲準開展二期臨床試驗,其他符合科創板定位的企業需具備明顯的技術優勢 并滿足相應條件”,且較前期征求意義稿的“一類新藥”改成“一項核心產品”,標準更寬、覆蓋范圍更廣,預計醫藥企業將是科創板的一股重要力量。