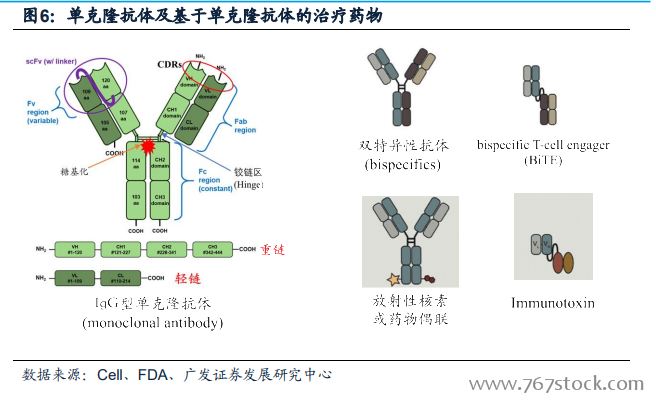
傳統治療藥物經數十年探索形成現有的標準治療方案。在人類與惡性腫瘤超過百年的戰斗歷史中,隨著人類對惡性腫瘤的認識不斷深入,其治療手段亦不斷發展,包括傳統的手術、化學治療(化療)和放射治療(放療)。最初,人類認識到惡性腫瘤的最大特點是腫瘤細胞的無限增殖,無限增值的背后是遺傳物質DNA的無限復制以及相應細胞元件的合成和修飾,針對這一特點,傳統意義上的廣譜抗癌藥如芥氮類、紫衫烷類、金屬鉑類等抗癌藥物先后誕生,至今這類藥物仍然是癌癥藥物治療的基礎用藥。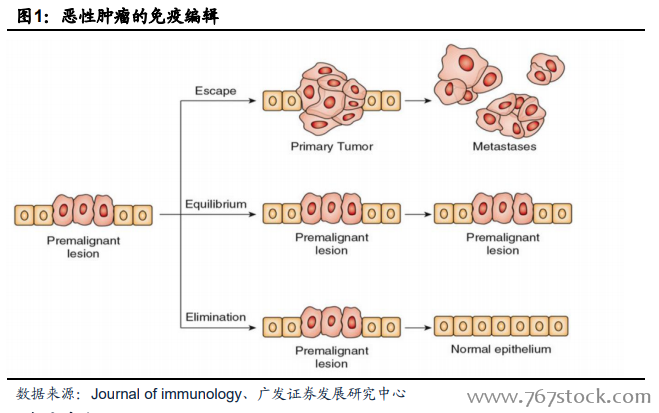
靶向治療將癌癥治療帶入“精準”時代。上世紀80年代,Vogelstein提出了“腫瘤源于基因突變”這一劃時代的概念并且首次確定了TP53 (DNA復制檢查點)作為抑癌基因的功能。而后,層出不窮的腫瘤突變基因被鑒定出來,針對這些突變的“靶點”開發上市了大量的靶向治療藥物,例如針對EGFR突變的吉非替尼、針對HER2的赫賽汀、針對費城染色體(Ph)的格列衛等。這期間也誕生不少細分領域的理論,譬如腫瘤細胞無限增值需要大量的營養物質和氧氣,從而誕生了阻斷腫瘤血管的“饑餓療法”,相關的藥物如靶向VEGF的單抗藥物貝伐珠單抗、靶向VEGFR的索拉非尼等相繼上市并創造了巨大的商業價值。圍繞“腫瘤源于基因突變”這一概念的藥物開發當前仍然十分火熱,其關鍵點在于發現“Driving mutation”的基因(即靶點),目前在很多惡性腫瘤已經發現不少“Driving mutation”,相關藥物亦在研發之中,我們將在后續的系列報告中詳細分析。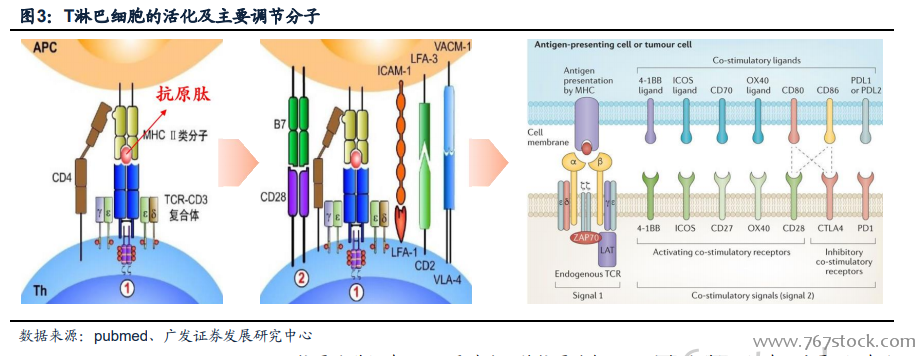
惡性腫瘤與機體的免疫系統。傳統治療和靶向治療的思路均是以惡性腫瘤為焦點,無論是傳統的手術、化療、放療還是時下火熱的靶向治療,其目的都是直接殺死惡性腫瘤細胞(饑餓療法屬于間接殺死,其次還有極少數的誘導分化療法如著名的“上海方案”)。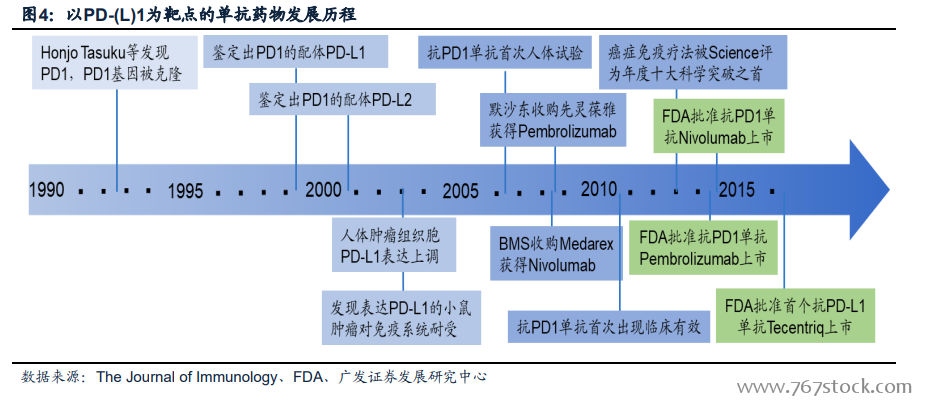
惡性腫瘤的免疫編輯。20世紀初期,Paul Ehrlich首次提出荷瘤體的免疫系統可識別并殺傷腫瘤。1959年,小鼠肉瘤排斥試驗證實了腫瘤抗原的存在,并認為其可誘導荷瘤機體產生特異性免疫應答。70年代,Burent正式提出機體的免疫系統能夠識別并殺傷癌細胞的免疫監視理論。隨后發現,免疫系統發揮免疫功能的同時,腫瘤細胞會改變表面抗原并調整腫瘤微環境來逃逸免疫系統的識別,從而逃避機體免疫監視,這個過程稱之為惡性腫瘤的免疫編輯(Cancer immunoediting),也是癌癥發生的免疫學過程,免疫編輯由三個過程構成,即免疫清除(Elimination)、免疫平衡(Equilibrium)和免疫逃避(Escape)。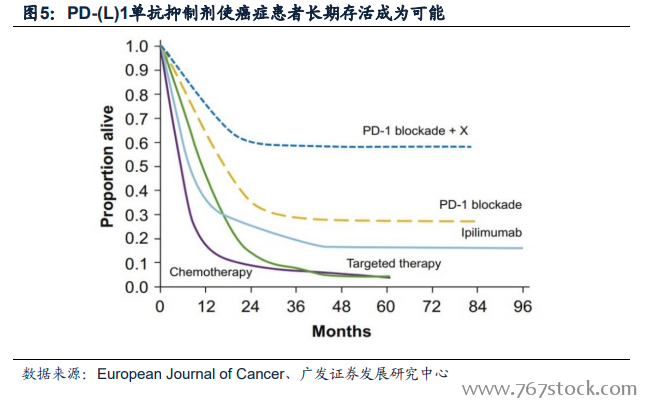
腫瘤免疫治療(Immunotherapy,I-O)的誕生。關于免疫逃逸背后的機制存在多種假說,主要有以下幾種,一種認為逃逸的主要原因是免疫系統的弱化;另一種假說認為逃逸的發生時惡性腫瘤抗原不足,不能對免疫系統造成足夠的刺激引發其清除異己的行動;還有一種假說認為惡性腫瘤具有正常的免疫原性,機體亦擁有正常的免疫功能,只是因為某種原因使免疫系統無法識別腫瘤抗原并發揮清楚異己的功能。針對上述假說,各種免疫治療應運而生,包括增強免疫的疫苗、結核桿菌甚至Ipilimumab等,以及使免疫正常化的PD-(L)1單抗抑制劑。免疫治療不同于傳統的手術、放化療和靶向治療的關鍵就是其全新的治療理念——利用機體正常的免疫系統殺滅體內的惡性腫瘤細胞。