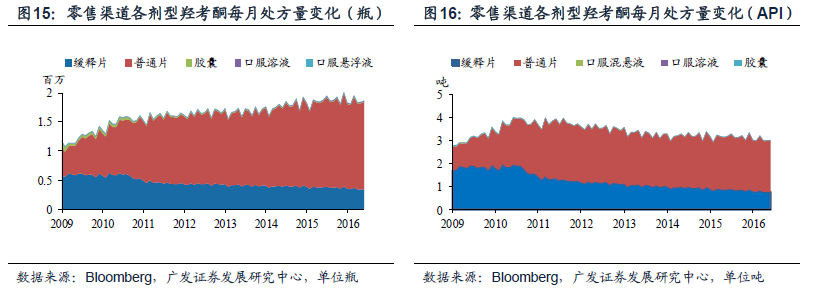
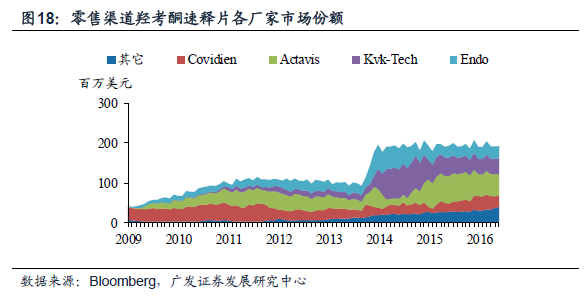
奧施康定是美國麻醉鎮痛市場的暢銷藥,年銷售額在25 億美金, 受到多個仿制藥廠家專利挑戰。奧施康定,又名鹽酸羥考酮緩釋片,主要治療中重度癌痛和慢性非癌痛。Purdue 藥業在1995 年上市第一代奧施康定,并在2010 年上市第二代仿濫用版本,第一代于2013 年撤市,目前主要是第二代藥物在銷售,年銷售額在25 億美金,通過兩大專利保護體系和市場獨占期維護壟斷經營的市場格局。2010 年開始,多個仿制藥廠商向原研發起了專利挑戰。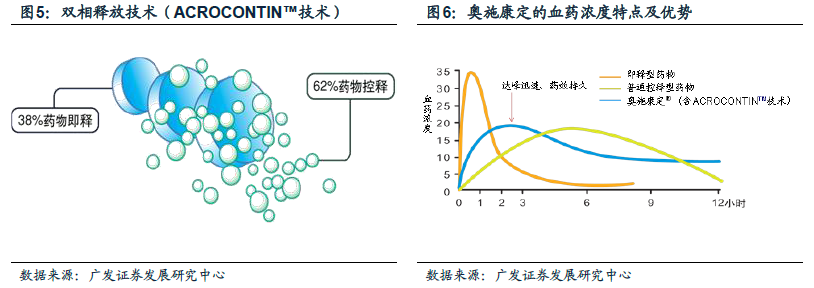
在關鍵專利的訴訟中,仿制藥企業均取得勝利,后續933 專利仍需進行挑戰。在2016 年2 月的判決中,聯邦巡回法院判決原研兩大專利體系無效,Epic 等公司無罪。但普渡制藥仍就剩余專利向Epic 等公司提起訴訟,目前訴訟案仍在進展中, 933 專利對原研保護程度有限,仿制藥企業占絕對優勢。
根據30-month-Stay 法則,仿制藥獲批不代表可以上市,可選多個上市方案。按照“若法庭沒有最后判決而ANDA 申請已屆滿30 個月,則ANDA 的批準也生效,生效日為ANDA 申請30個月屆滿日,但ANDA 申請人須自行承擔上市風險。雙方當事人也可以就此事達成和解”,仿制藥企業如果在2012年12 月15 日提交P4 申請,2013 年1 月30 日,原告方提請訴訟,按照30-month-stay 計算,2015 年7 月30 日30個月遏制期滿(在這期間FDA 并不停止對ANDA 材料的評審)。按照一般ANDA 申報生產大概為30 個月,到目前已經超過40 個月,我們認為ANDA 預計已經到了FDA 審批的后期。我們認為ANDA 獲批之后,仿制藥企需要視后續專利挑戰進展選擇具體上市節奏,但與原研和解,獲得一部分授權仿制藥份額也是一個很好的方案。
羥考酮ER 仿制藥有望保持一定市場規模,授權仿制藥市場規模正在不斷擴大。通過對羥考酮ER 的銷量和價格進行敏感性分析,我們認為未來ER 仿制藥市場規模有望保持一定市場規模;自2013 年不斷有廠商在訴訟后與Purdue 達成和解以取得授權仿制藥,2014 年起已陸續有6 家企業通過這種方式開始銷售,2016 年,6 家廠商授權仿制藥額度約2.8 億美金左右。