免疫原性對抗體藥物的安全性和有效性影響重大,人源化單抗和全人源單抗成為主流。目前市場上的單克隆抗體藥物可以分為鼠源抗體、嵌合型抗體、人源化抗體和全人源化抗體這四類。人源化抗體和全人源化抗體需要轉基因小鼠或者噬菌體,研發成本較高。但相對于鼠源抗體和嵌合型抗體,人源化抗體和全人源化抗體更不易引起人體的免疫原性反應,副作用較小。2017年獲批的10款抗體藥物中,有6款全人源抗體和4款人源化抗體。截至2017年,全球上市的單抗藥物中80%為人源化抗體和全人源抗體。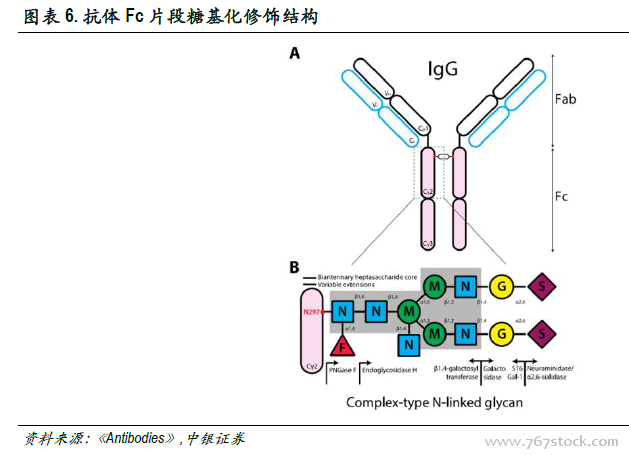
單抗Fc片段糖基化修飾顯著強化單抗藥物細胞毒作用。Fc片段通過活性區域與受體相結合發揮效應子功能。人類具有多種效應子配體(如FcyRs、C1q補體等),IgG的N-糖基化位于Fc片段的CH2區的共有序列(Asn297-X-Ser/Thr,X可以是除脯氨酸的任意氨基酸殘基),通過酰胺鍵與抗體共價結合。Fc糖基化糖分子具有復雜的雙天線型核心結構,該結構由甘露糖(Man)和N-乙酰葡糖胺(GlcNAc)兩種戊糖分子組成,不同糖型除核心結構外還含有不同數目的糖分子,如巖藻糖(Fuc)、甘露糖、N-乙酰葡糖胺、半乳糖(Gal)、二等分N-乙酰葡糖胺和唾液酸(Sia)。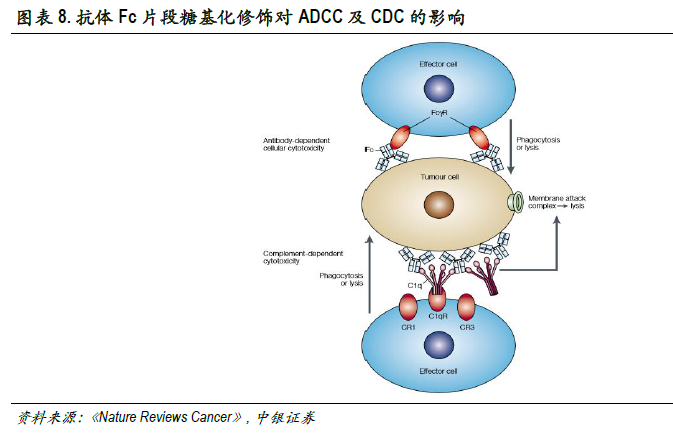
抗體偶聯藥物(ADC)可降低化藥毒性,但制備技術仍是需要攻克的難點。抗體偶聯藥物(ADC),是一種將化學類藥物通過連接物(linker)與抗體偶聯形成的藥物,進而降低化療中常用藥物非特異性的全身毒性。抗體偶聯藥物經過血液運輸到達并識別癌細胞的表面抗原,其抗體部分與抗原結合后被內吞進入癌細胞內部并進一步在溶酶體中被剪切,釋放有殺傷作用的化合物類藥物(作用于DNA或細胞微管蛋白)。內吞化學類藥物的細胞死亡裂解后,毒素分子會釋放至附近的其他腫瘤細胞進一步發揮殺傷作用。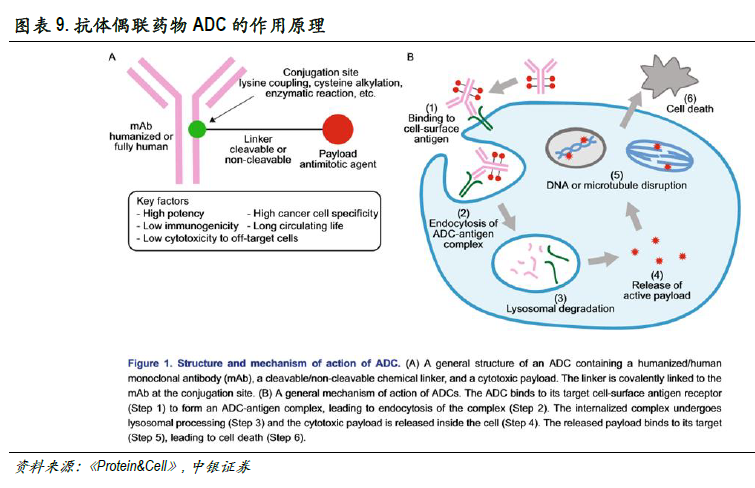
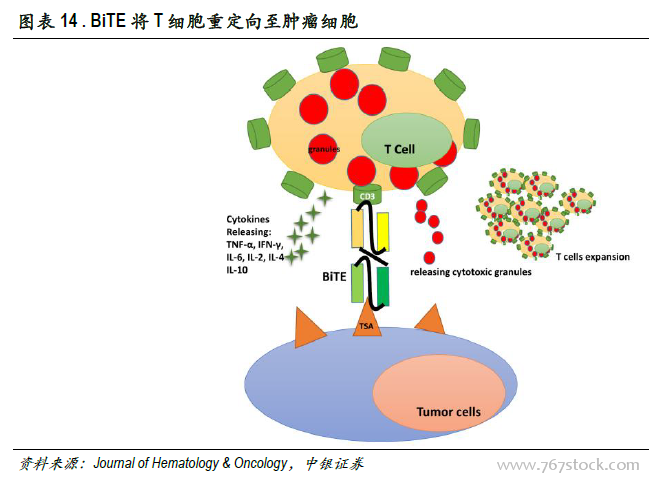
雙特異性抗體具有“1+1>2”的腫瘤治療效果。從靶點來源角度,雙特異性抗體可以分為兩種,即T細胞募集型和腫瘤雙靶點結合型。腫瘤雙靶點結合型可同時結合腫瘤細胞的兩個靶點(如VEGF-PDGF、VEGF-Ang2),單克隆抗體通常只靶向一個抗原或一個表位,而某些疾病的發生常常與多條信號通路相關,導致疾病的復發,雙抗可以抑制2條信號通路減少產生耐藥的可能性。T細胞募集型雙抗靶向腫瘤細胞靶點和T細胞募集位點,占雙抗的大部分,T細胞募集位點一般靶向CD3(T細胞)、CD16靶點(NK細胞),可將T細胞重定向到腫瘤細胞,避免腫瘤細胞的免疫逃逸。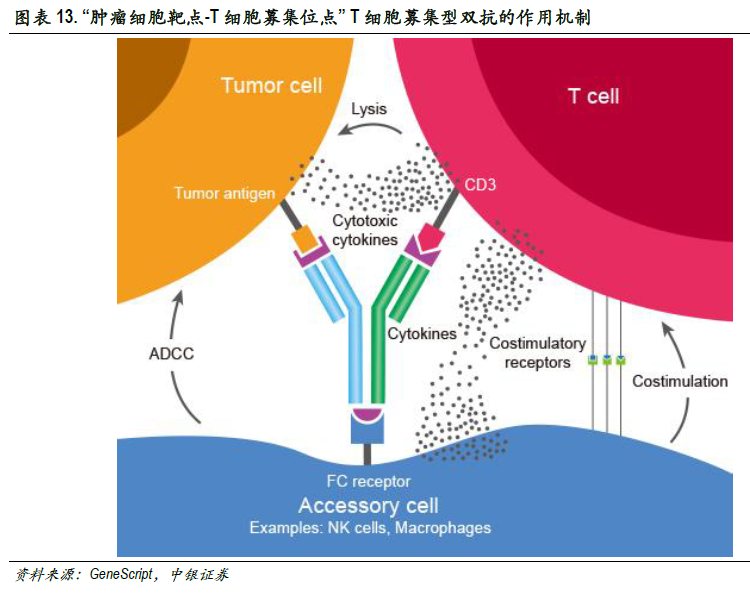
PD-(L)1單抗避免癌細胞的免疫逃逸,開啟免疫治療時代。由PD-1及其配體PD-L1、PD-L2組成的通路在維持外周免疫耐受中起著關鍵作用,而腫瘤也利用該途徑從T細胞介導的特異性免疫中逃逸。T細胞處于激活狀態時會進行代謝重編程,有氧糖酵解成為主導的代謝過程;谷氨酰胺的攝取和分解代謝也會增加,這些都是效應T細胞的適應性和記憶T細胞發育所需要的。腫瘤細胞通過PD-1抑制氧耗量,并削弱了活化T細胞參與糖酵解和分解谷氨酰胺的能力。當T細胞受到PD-1配體結合的刺激后,細胞內開始聚集公認的T細胞免疫抑制劑——大量的多不飽和脂肪酸。通過限制T細胞的正常代謝, T細胞的分化模式改變,導致效應T細胞(TEFF)和記憶T細胞(TM)的分化減弱、調節性T淋巴細胞(Treg)和耗竭T細胞(TEX)的分化增強。PD-L1作為癌細胞上的抑制受體,能將抗凋亡信號傳遞給癌細胞,癌細胞開始進行高度糖酵解,PI3K-Akt-Mtor通路活化水平升高,最終導致癌細胞的存活改善。