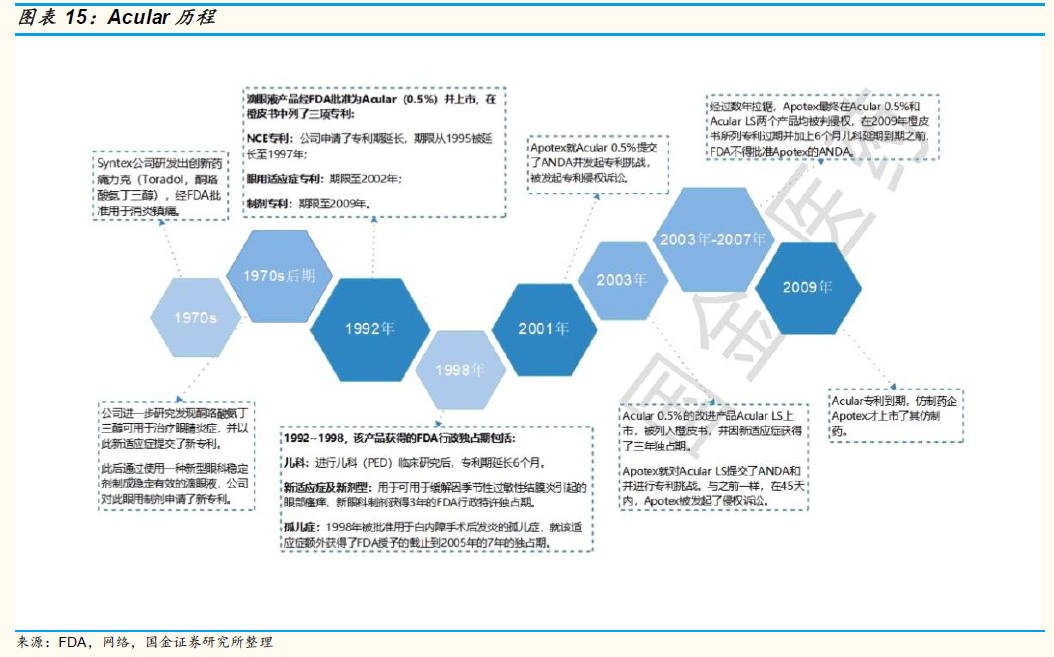
藥審與國際接軌,制劑出口企業獲得政策扶持。2015 年以來,醫改政策不斷,其中藥品的研發端、生產端、應用端均有密集政策推出,推動醫藥供給側改革,去蕪存菁、鼓勵創新。制劑出口企業的產品有望通過優先審評審批通道加速評審,上市后視同通過一致性評價,在藥品招標和銷售方面獲得優勢,加速進口替代。從而實現彎道超車,獲得市場份額。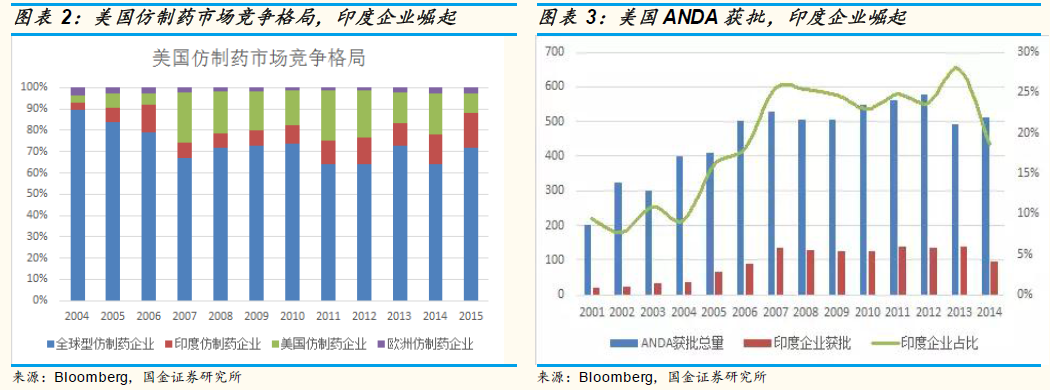
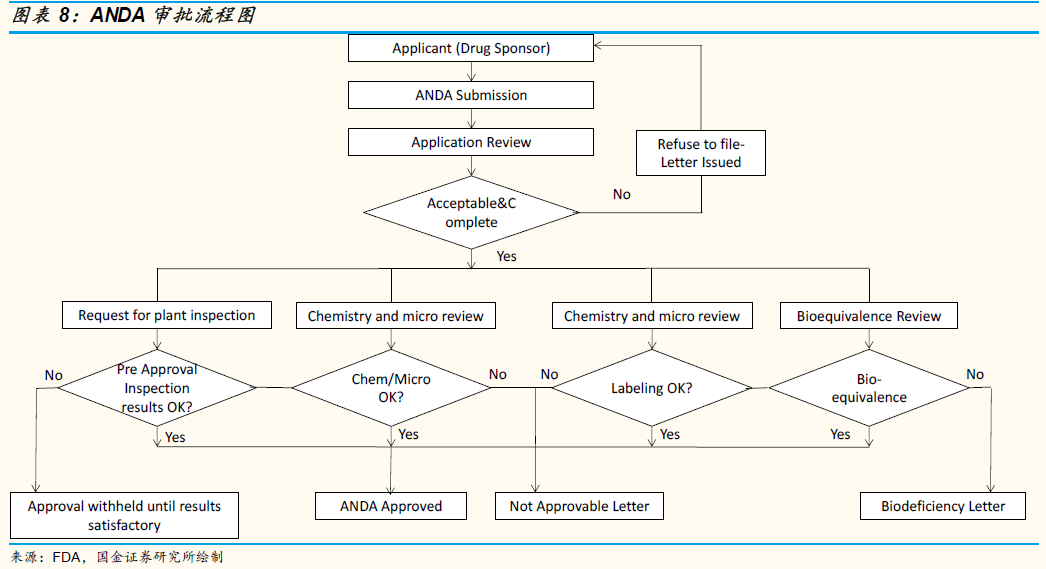
2017 年6 月,CFDA 正式加入ICH,標志著國際社會對中國政府藥品審評審批改革和中國醫藥產業的認可,有利于中國醫藥行業在研發、監管等各方面與國際接軌。近期的許多藥審政策,如“中國版橙皮書”《中國上市化學藥品目錄集》第一批收錄品種的發布、《拓展性同情使用臨床試驗用藥物管理辦法》(征求意見稿)、《關于調整藥物臨床試驗審評審批的公告(征求意見稿)》、兩部關于eCTD 的征求意見稿(《藥品電子通用技術文檔機構(征求意見稿)》、《化學仿制藥電子通用技術文檔申報指導原則(征求意見稿)》)等等,均與美國FDA 進行了接軌。
從美國每年獲得的ANDA 文號來看,印度企業在2001 年每年獲批的ANDA 僅有十幾個,占比不到10%,之后每年獲得ANDA 文號迅速增長,目前超過20%。ANDA 證書數量的增長表明印度仿制藥企業發展迅猛。未來隨著中國藥企研發能力的提升、鼓勵優質藥品,中國企業出海ANDA 也將逐步提升。