評價范圍:涉及11.6萬批文,2018年底前完成17740批文。約涉及11.6萬個批文的仿制藥。根據國家政策要求,化學藥品新注冊分類實施(2016年3月4日)前批準上市的仿制藥,凡未按照與原研藥品質量和療效一致原則審批的,均須開展一致性評價。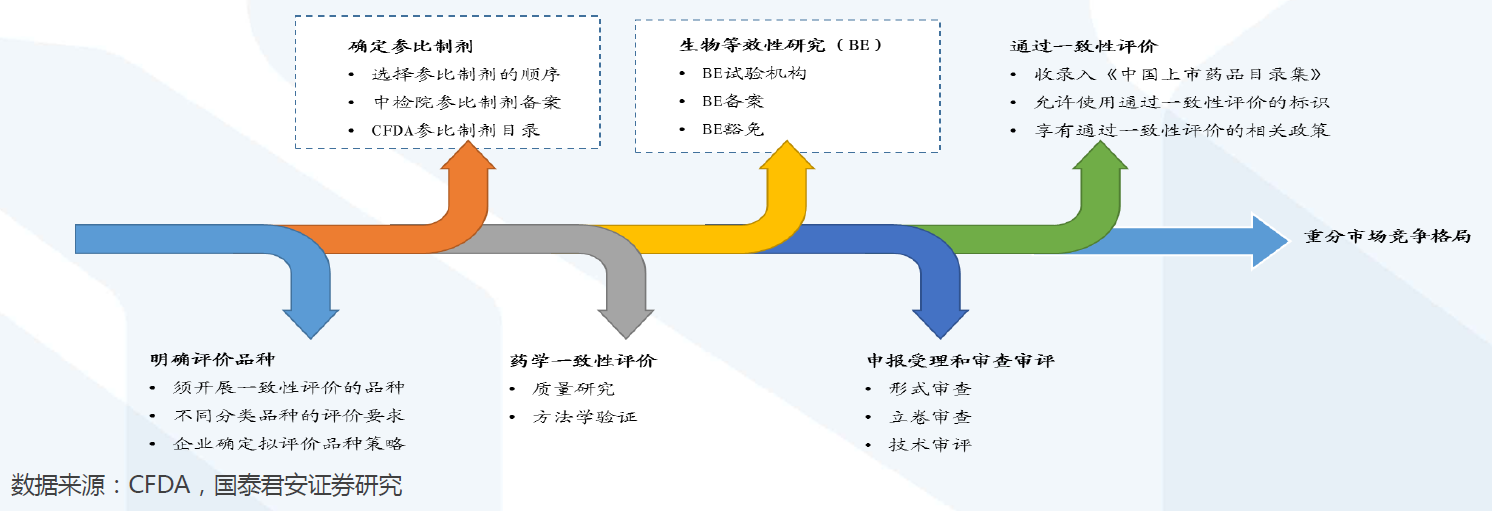
評價流程:確定參比制劑與開展BE試驗是兩大關鍵。開展仿制藥質量和療效一致性評價工作,要求已經批準上市的仿制藥品, 在質量和療效上與原研藥品能夠一致,臨床上與原研藥品可以相互替代。
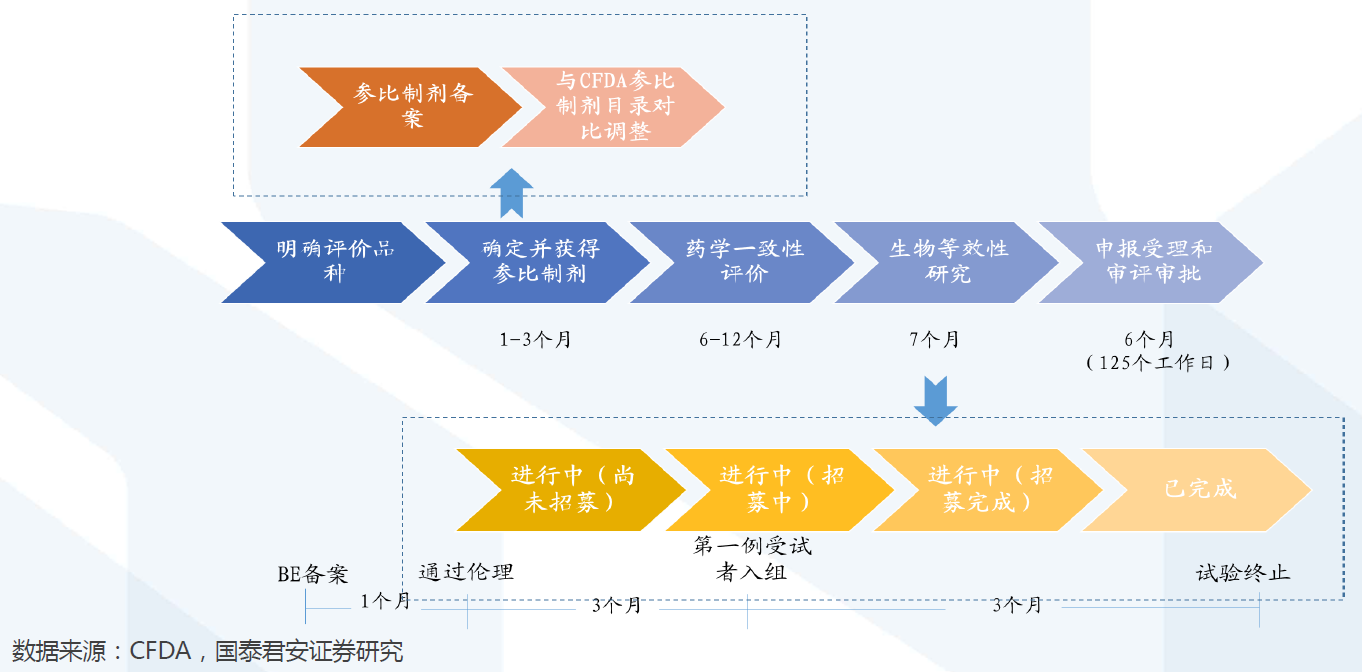
評價時間: 單個品種通過一致性評價周期約為20-28個月。單個品種通過一致性評價的周期約為20-28個月,其中:①確定并獲得參比制劑需1-3個月;②開展藥學一致性評價需6-12個月;③開展BE試驗需7 月左右(從BE備案至試驗終止);④申報受理和審評審批需6個月左右。


