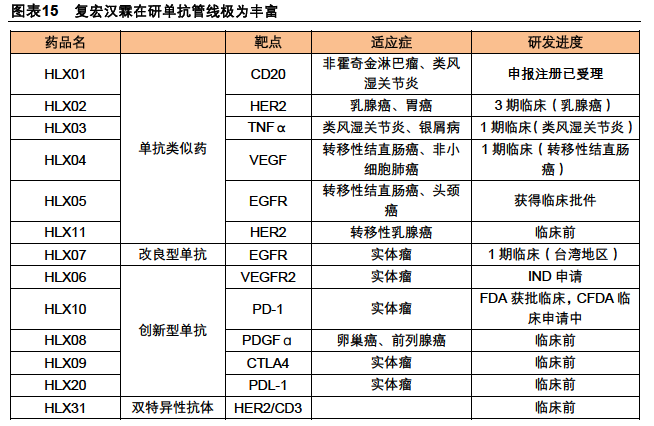
生物類似藥臨床研究策略:頭對頭對比+適應癥外推。臨床研究策略主要是指藥物進行臨床試驗的整個思路,包括選擇適應癥、臨床試驗類別、臨床終點以及審評審批路徑等。根據CDE的兩份意見稿,我們認為,在生物類似藥的臨床研究策略是在最有利適應癥的基礎上選擇頭對頭等效性實驗,這樣可獲得外推其它適應癥的批準。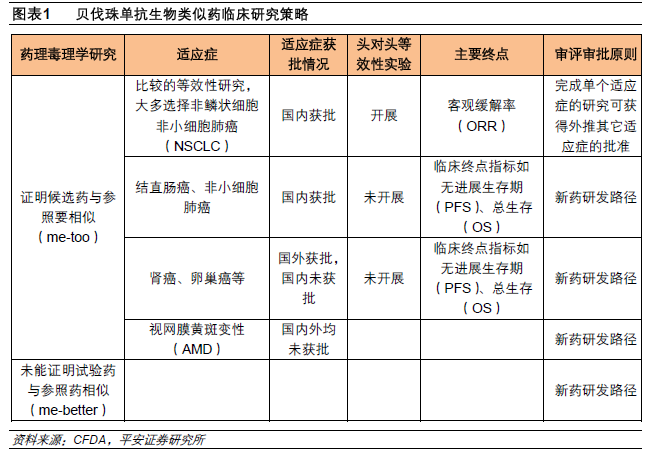
生物類似藥臨床研究設計要點:選擇與原研藥臨床試驗一致的條件。臨床研究設計要點主要是指藥物臨床試驗的具體方案,涉及到研究對象、給藥劑量、樣本量、終點指標等方面。從CDE的征求意見稿可以看出,在生物類似藥臨床試驗中盡量選擇與原研藥臨床試驗一致的條件,在最優選擇的情況下進行臨床試驗。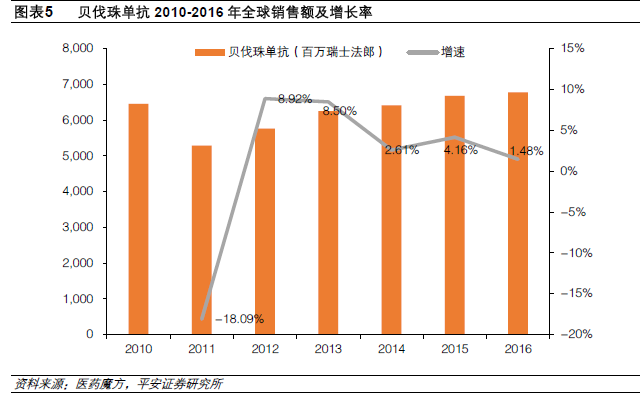
貝伐珠單抗:生物類似藥剛獲FDA批準上市。貝伐珠單抗是由羅氏研發的第一個以VEGF作為靶點的人源化單克隆抗體,該藥可以通過阻斷VEGF從而抑制腫瘤的血管新生,切斷腫瘤區域的供血,抑制腫瘤的生長和轉移,產生抗腫瘤作用。貝伐珠單抗最初的適應癥為結直腸癌,隨后陸續有多種適應癥獲批,包括非小細胞肺癌、腎細胞癌、惡性膠質瘤、宮頸癌和復發性卵巢上皮癌。貝伐珠單抗于2004年2月26日在美國上市,該藥美國專利將于2019年7月到期,歐洲的專利保護2018年到期。2016年貝伐珠單抗的全球銷售額67.83億瑞士法郎(+1.48%),過去5年CAGR5%,位居全球十大暢銷藥物第7位。我們預計,由于專利到期后類似藥的上市,到2020年貝伐珠單抗的全球銷售額將降至63.6億美元。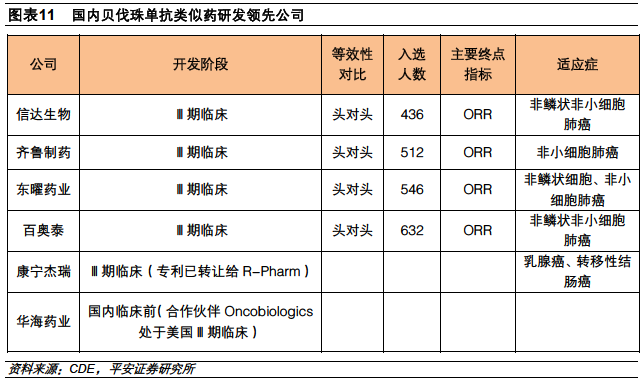
安進/艾爾健的Mvasi臨床療效與Avastin無差異。Mvasi是安進與艾爾健聯合開發的貝伐珠單抗類似藥。2016年11月,公司向FDA遞交了Mvasi的生物制品申報許可申請(BLA),是貝伐珠單抗類似藥研發企業中的首家。Mvasi完成了非鱗狀非小細胞肺癌(NSCLC)的3期臨床試驗(NCT01966003),完成了藥代動力學、藥效學、臨床免疫原性、臨床安全性以及臨床療效等方面的試驗。
海外貝伐珠單抗類似藥研發火熱。貝伐珠單抗優秀市場表現使其成為熱門仿制對象,目前已有4個貝伐珠單抗類似藥在俄羅斯(1個)、阿根廷(1個)、印度(2個)上市,對于美國、歐洲、日本等規范市場,基本都處于臨床試驗階段。FDA批準首個貝伐珠單抗類似藥意味著這些仿制藥將從臨床試驗階段轉向上市銷售階段,目前國外有11個處于臨床Ⅲ期的在研項目,未來將會迎來貝伐珠單抗類似藥的上市高潮。