全球及國內市場:處于起步階段,快速增長。據 Markets and Markets 數據,2017 年,全球伴隨診斷市場規模為 26.1 億美元,預計 2018-2022 年將達到31.3 億、37.6 億、45.1 億、54.2 億、65.1 億美元,2016 年到 2022 年的年復合增長率將達到 22.78%,顯著高于全球 IVD 整體行業 6%的增長速度。作為體外診斷市場發展最快的細分領域之一,伴隨診斷在體外診斷市場的份額逐漸增大,伴隨診斷占體外診斷市場占比由 2010 年的 2.9%增長至 2021 年的 14%。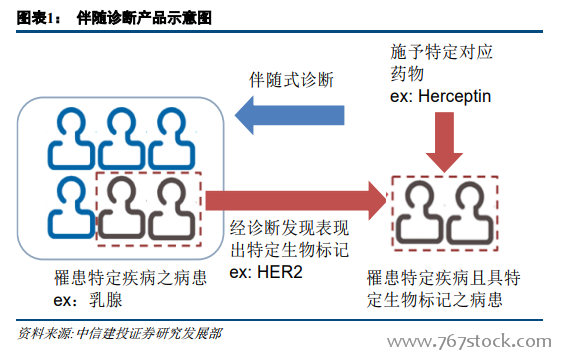
歐美伴隨診斷行業發展與治療理念、審批政策和醫保覆蓋息息相關。美國引領精準醫療創新,治療理念亦最先切換至個體化診療,審批政策上采取治療藥物與其伴隨診斷同步審評,藥審和器審合作審批的形式。歐洲在精準醫療領域呈現追隨趨勢,但歷史原因其藥品審評與診斷審評分由兩個部門負責,協同性有待整合。從醫保覆蓋看,2018 年美國 CMS 已確定覆蓋 NGS 伴隨診斷,歐洲各國則有差異化政策,其中法國醫保覆蓋最全面,英國和意大利覆蓋較少。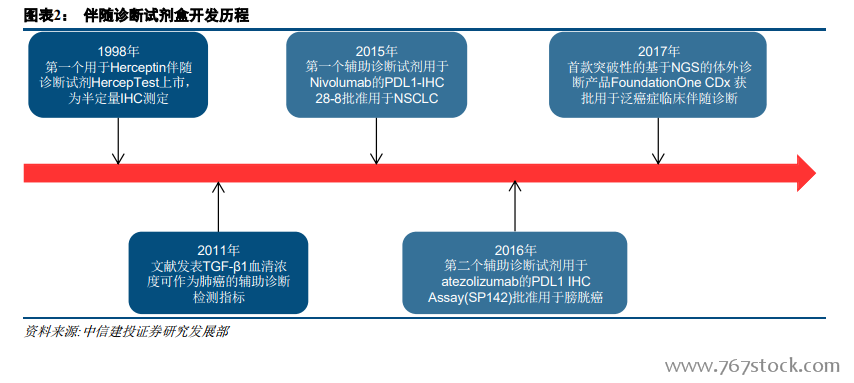
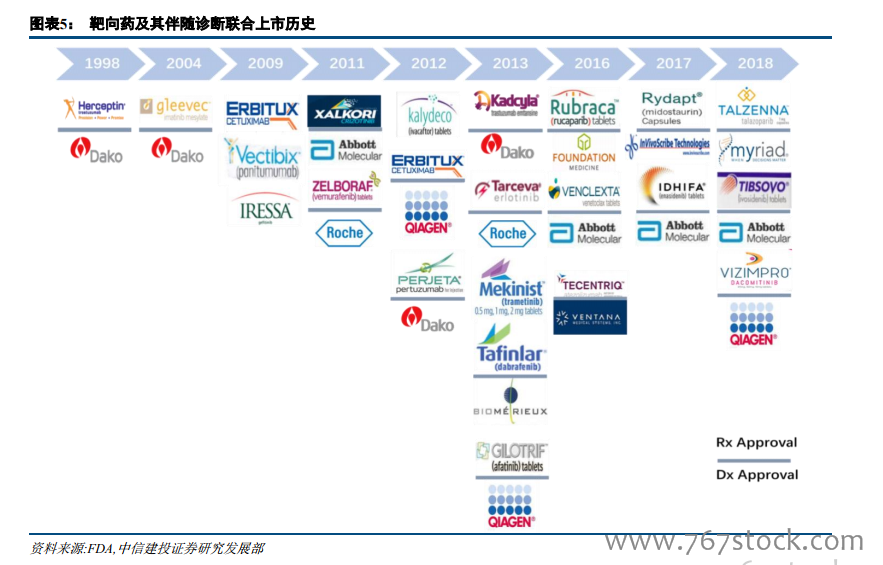
美國已經批準上市的伴隨診斷試劑達 35 個。截至 2018 年 12 月,FDA 批準的伴隨診斷產品一共有 35 個。從靶點分布看,HER2 伴隨診斷是首個伴隨診斷產品,且數量最多,達到 10 個,其次是 EGFR、ALK 等常見肺癌伴隨診斷,從適應癥來看,乳腺癌和非小細胞肺癌是主要適應癥,對應伴隨診斷數量分別是 11 個、8 個,從技術分類看,PCR 和 IHC 仍是主流技術,近三年 NGS 產品發展較快,2016 年首個 NGS 伴隨診斷產品上市,截至 2018 年 12 月,已有 4 個產品獲得 FDA 批準。