新藥研發熱情高漲。新藥研發是醫藥行業永恒的主題,也是行業和制藥公司發展的根本動力。2000 年以來,每年在研新藥的數量持續上升,屢創新高,2017 年達到 1.5 萬,是 2001 年的 2.5 倍。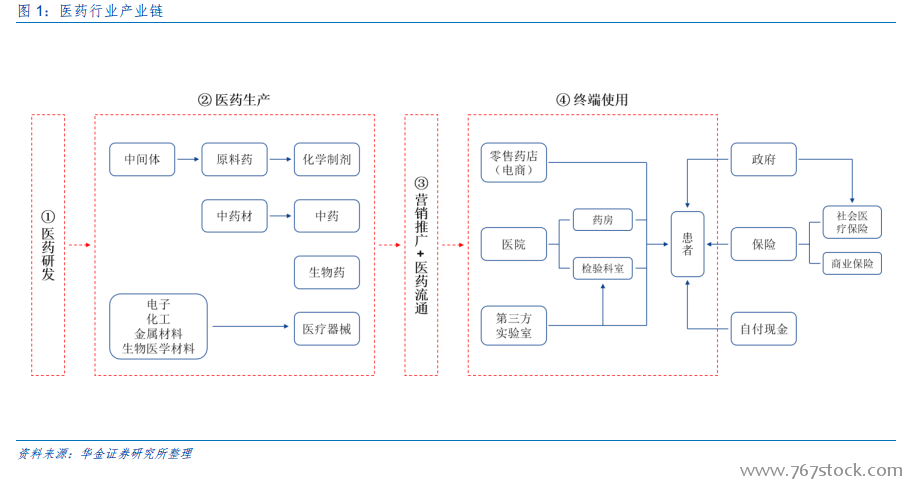
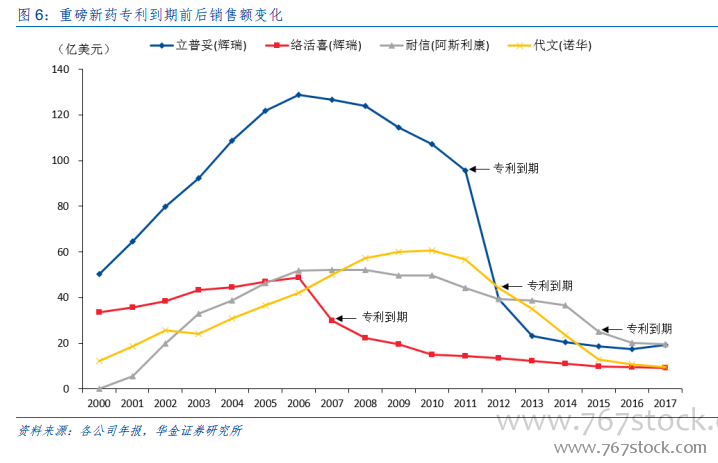
應對現有產品專利到期的被動選擇:縱觀國際重磅藥物的歷史銷售數據可以發現,新藥在專利到期以后通常會由于仿制藥的競爭,銷售額發生斷崖式下降,且銷售額峰值越高的藥物出現這種現象就越明顯,如輝瑞用于高膽固醇血癥治療的藥物——立普妥,銷售峰值高達 120 多億美元,目前的銷售額僅剩 20 億美元。因此,為了避免新藥專利到期對公司業績帶來的巨大沖擊,藥企只能通過不斷的自主研發或收購新藥項目來豐富自身的新藥產品線,以抵抗業績的急劇下滑。
一致性評價政策落地,仿制藥臨床研發外包需求集中爆發:根據一致性評價政策的規定,(1)國家基藥(2012 年版)中 2007 年 10 月 1 日前批準上市的化學藥品仿制藥的口服固體制劑,應在 2018 年底前完成一致性評價。據此粗略統計,理論上到 2018 年底將有共計 289 個品種的19715 個批文需要完成一致性評價,共涉及 2028 個企業。(2)化學藥品新注冊分類實施前批準上市的其他仿制藥,自首家品種評價完成后,其他家相同品種應在 3 年內完成,逾期未完成的,均不予再注冊。(3)同品種藥品通過一致性評價的生產企業達到 3 家以上的,在藥品集中采購等方面不再選用未通過一致性評價的品種。因此,在政策落地后的短短幾年時間里,大量已上市的仿制藥需要重新進行并完成一致性評價,時間緊、任務重,因此將這部分工作外包給專業的公司和團隊去負責就成了必然的選擇。此外,未來仿制藥在獲批上市之前均需要通過一致性評價,這也為醫藥合同外包服務行業提供了新的市場需求。