申請受理提速,未來不再按批公布。從CDE受理情況來看,每月受理數量呈上升趨勢。從2017年7月陸續有企業申報一致性評價,截至2018年7月24日,共有受理號261個,其中2017年承辦71個,2018年承辦190個。2017年每月平均承辦12個,2018年目前為止月均26個,并且在2018年6月份達到新高的59個。值得注意的是,為提高工作效率,本次公告后通過一致性評價的品種,CFDA將不再分批公告,獲批品種將及時納入《中國上市藥品目錄集》。我們認為這在一定程度上體現了隨著受理速度的提升,未來獲批速度也將隨之提高,分批公布的方式在信息傳遞上效率不高。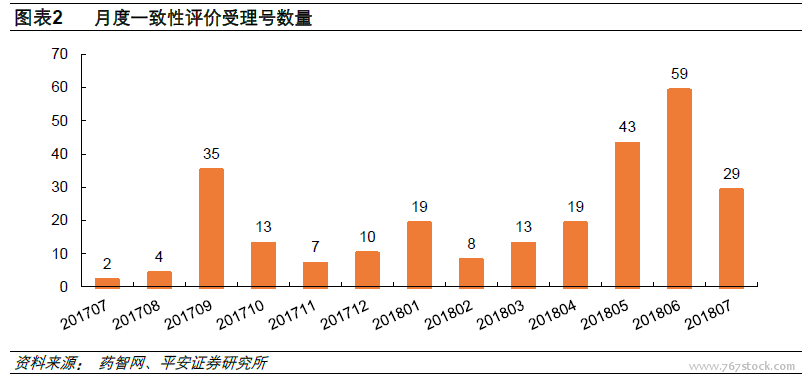
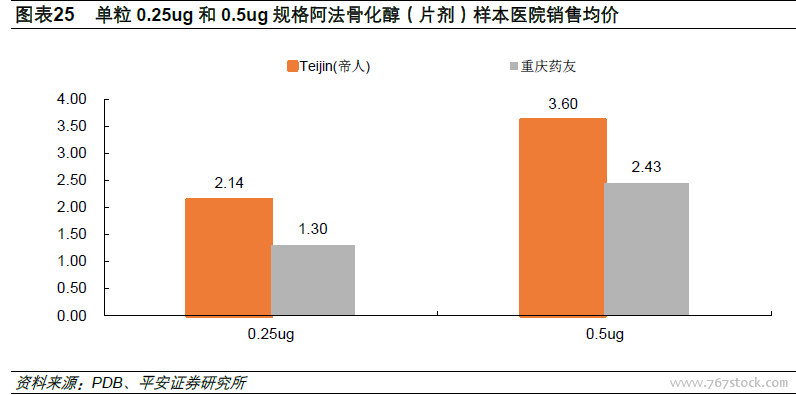
289目錄通過品種占比低,瑞舒伐他汀和蒙脫石散“3+1”結構成立。前五批共有29個品種落地,對應57個受理號,其中屬于289目錄的品種有13個,289目錄完成度僅4.5%。另外,第五批目錄公布后,達成“3+1”格局(即1家原研加3家國產仿制藥)的一致性評價品種出現,分別是瑞舒伐他汀(正大天晴、京新藥業、海正藥業)和蒙脫石散(先聲藥業、四川奧維、揚子江)。根據此前一致性評價政策規定:同品種藥品通過一致性評價的生產企業達到3家以上的,在藥品集中采購等方面不再選用未通過一致性評價品種。我們認為,對于瑞舒伐他汀和蒙脫石散來說,已經通過一致性評價的企業有望率先享受藥品招采的優惠政策,尚未通過的企業則必須把握僅剩的時間窗口。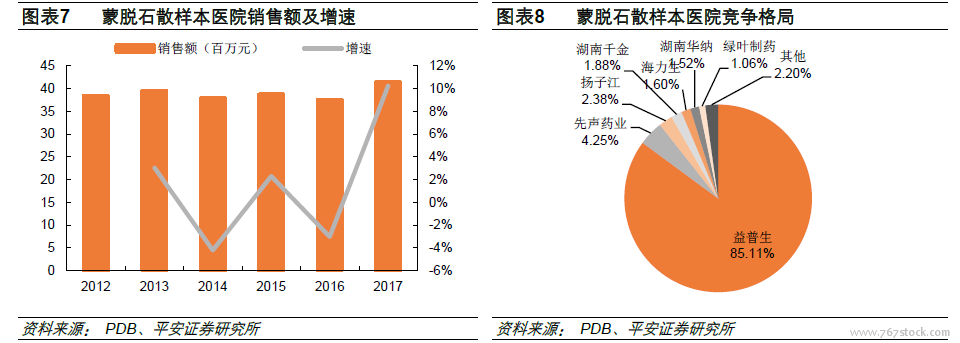
支持政策爭相落地,替代原研成主旋律。從2016年3月5日國務院辦公廳發布的《關于開展仿制藥質量和療效一致性評價的意見》到總局2017年第100號文,多個重磅一致性評價相關文件均提到對通過一致性評價的品種給予優待,主要歸結為3個方面:一是社會保障部門在醫保支付上予以適當支持;二是醫療機構優先采購并在臨床上優先選用,同品種藥品通過一致性評價的企業超過3家的,衛生計生部門在集中采購方面不再采用未通過品種;三是通過一致性評價的企業在符合有關條件的情況下,可以向發展改革、工信和財政等部門申請中央基建投資、產業基金等資金支持。