生物類似藥有效成分結構復雜難以仿制。仿制藥品的技術關鍵可以簡單劃分為兩個方面,一個是有效成分(Active PharmaceuticalIngredient, API)的仿制,另一個是制劑工藝的仿制。對于化學仿制藥來說,有效成分通常是通過化學合成的小分子,結構明確,仿制較為容易,仿制難點通常出現在制劑工藝上。尤其對于口服化學仿制藥,制劑工藝直接會影響藥品的在人體內的溶解、吸收、代謝,進而影響藥品的治療效果。而生物類似藥由注射給藥,一般情況下不存在由制劑工藝引發的溶解、吸收問題,而有效成分的仿制通常是技術難點。生物類似藥的有效成分一般是生物合成的大分子蛋白質,分子結構復雜,生產流程長,因此實現有效成分的相似性是較為困難的。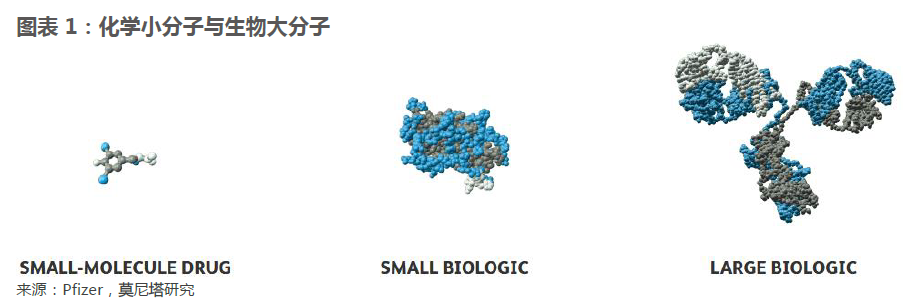
生物類似藥的臨床驗證更加復雜。生物類似藥與原研藥的等效性需要更多的驗證,因此其臨床試驗也比化學仿制藥更加嚴格。以我國為例,我國的化學仿制藥經歷了野蠻生長的時期,目前正處于逐漸規范的過程中。2016年4月開始的仿制藥一致性評價工作對化學仿制藥的技術評價標準有了一次提升,預計未來我國的化學仿制藥都將按照此次一致性評價的標準進行審批。因此我們對比一致性評價系列文件中對化學仿制藥的評價標準與《生物類似藥研發與評價技術指導原則》中對生物類似藥的評價標準,可以發現生物類似藥的評價內容更多,評價流程更復雜。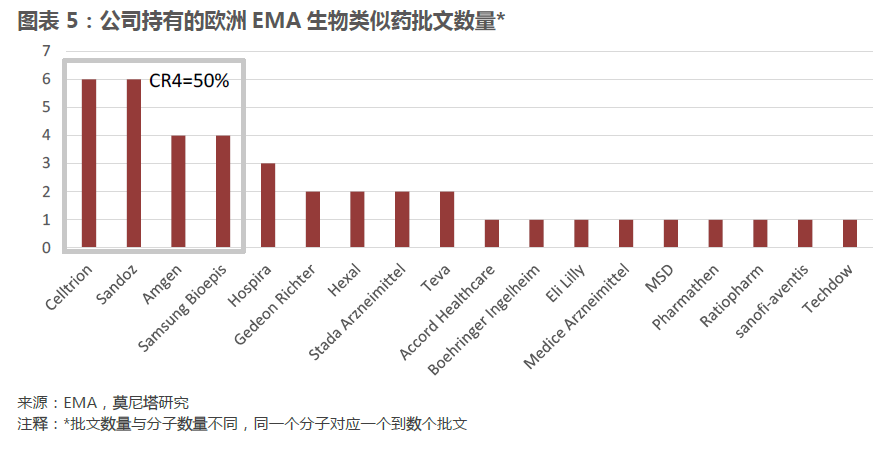
生物類似藥的研發時間與費用顯著高于化學仿制藥,而低于創新藥。因此生物類似藥的研發門檻顯著高于化學仿制藥,生物類似藥研發所需的時間與資金高于化學仿制藥。一個化學仿制藥的研發通常花費不會超過500萬美元,以及2~4年的時間,而生物類似藥則需要至少1億美元與4~6年的時間。
原研藥專利到期后,生物類似藥難以快速跟進。生物類似物的研發較為困難,研發難度也比化學仿制藥更高一些。比如英夫利昔單抗,商品名Remicade,其原研藥的銷售峰值于2016年接近70億美元,是全球銷售金額第5大的產品。該產品的歐洲專利于美國專利分別于2015年、2018年到期,巨大的市場空間自然會吸引眾多仿制藥公司進行研發。但是距今為止其歐洲專利到期已經過去3年,在歐洲及美國獲批的類似物僅4款,與化學仿制藥到期后蜂擁而至的十余家甚至而是余家接連獲批的盛況截然不同。甚至部分公司在研發的過程中折戟沉沙、項目終止。
生物類似藥批文數量集中于少數幾家公司。歐洲EMA批準的一共40個生物類似藥批文歸屬于18家公司,其中擁有批文最多的前四家公司覆蓋了20個批文,占比50%,批文集中度較高。雖然在這18家公司中不乏Sandoz、Teva這樣的傳統仿制藥企業,但是在領先公司中,Celltrion、Samsung Bioepis這樣成立時間不久,專門進行生物類似物研發的公司的表現格外搶眼。


