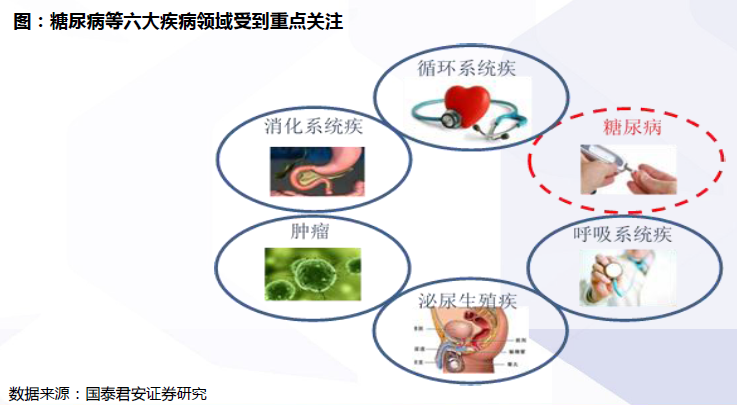
仿制藥一致性評價:中國醫藥行業2018年最重要的變革。2016年3月5日,國務院辦公廳印發《關于開展仿制藥質量和療效一致性評價的意見》(國辦發〔2016〕8號),標志中國仿制藥質量和療效一致性評價工作全面展開。仿制藥一致性評價是中國醫藥行業2018年最重要的變革,大浪淘沙下,“剩”者為王,中國制藥工業迎來長周期新起點。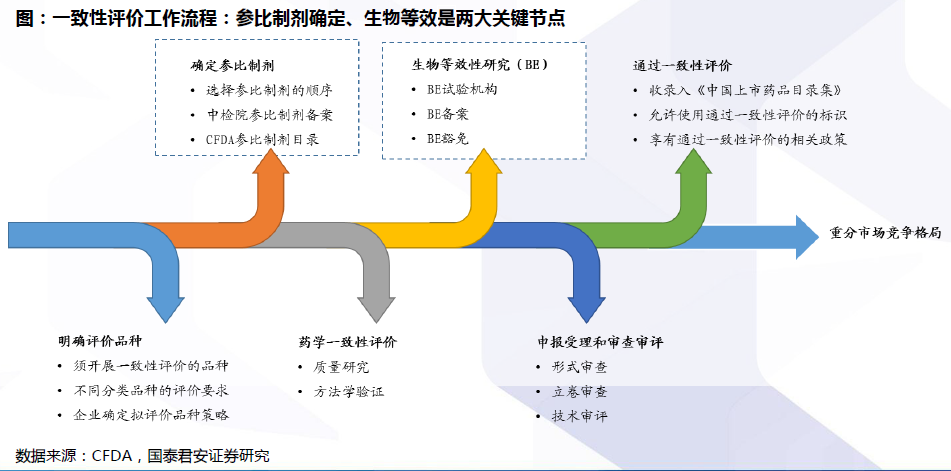
評價范圍:涉及11.6萬批文,2018年底前完成17740批文。約涉及11.6個批文的仿制藥。根據國家政策要求,化學藥品新注冊分類實施(2016年3月4日)前批準上市的仿制藥,凡未按照與原研藥品質量和療效一致原則審批的,均須開展一致性評價。2018年底前需完成289個基藥品種、17740個批文的評價工作。凡2007年10月1日前批準上市的列入國家基本藥物目錄(2012年版)中的化學藥品仿制藥口服固體制劑,原則上應在2018年底前完成一致性評價。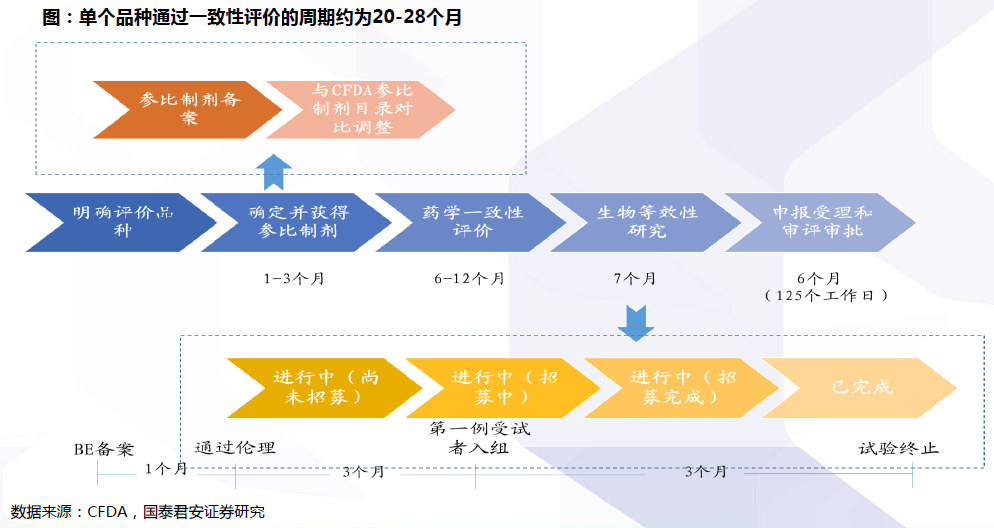
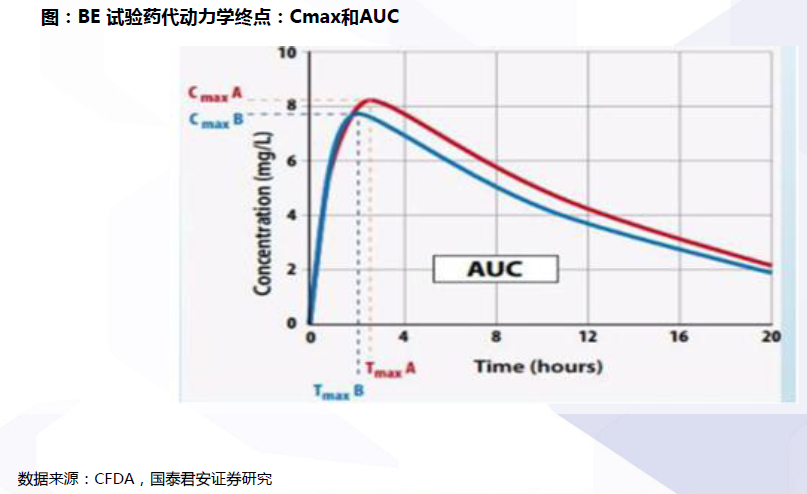
評價流程:確定參比制劑與開展BE試驗是兩大關鍵。開展仿制藥質量和療效一致性評價工作,要求已經批準上市的仿制藥品, 在質量和療效上與原研藥品能夠一致,臨床上與原研藥品可以相互替代。因此,一致性評價的兩大關鍵為:確定參比制劑:參比試劑是指“用于仿制藥質量和療效一致性評價的對照藥品,通常為被仿制的對象,如原研藥品或國際公認的同種藥物,參比制劑應為處方工藝合理、質量穩定、療效確切的藥品”。開展BE試驗:生物等效性(BE)是指“在相似的試驗條件下單次或多次給予相同劑量的試驗藥物后,受試制劑中藥物的吸收速度和吸收程度與參比制劑的差異在可接受范圍內”。