免疫療法:開啟腫瘤治療的新時代。腫瘤免疫治療是指應用免疫學原理和方法,提高腫瘤細胞的免疫原性,激發和增強機體抗腫瘤免疫應答,從而抑制腫瘤的生長。由于其毒副作用小、療效明顯等特點,腫瘤免疫治療有望成為繼手術、化療、放療和靶向治療后,腫瘤治療領域的一場革新。腫瘤免疫療法目前包括細胞因子、腫瘤疫苗、過繼性細胞治療、溶瘤病毒、免疫檢查點阻斷幾種主要的治療方法。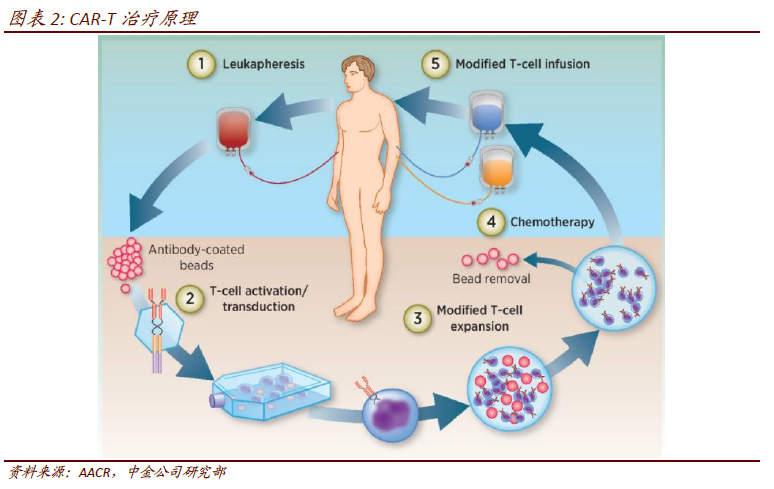
CAR-T 細胞治療:不受MHC 分子限制,腫瘤識別和殺傷更高效。細胞免疫療法主要指過繼性細胞治療(ACT),可分為非特異性和特異性,前者包括NK、CIK等,后者包括DC-CIK、TCR-T、CAR-T 等。CAR-T 療法(Chimeric Antigen Receptor T-Cellimmunotherapy)全稱嵌合抗原受體T 細胞免疫療法,其原理是將病人體內取得的T 細胞,用基因工程的方法經激活、轉染、修飾、擴增后,重新注射到病人體內,通過激發人體自身的免疫系統來消滅腫瘤。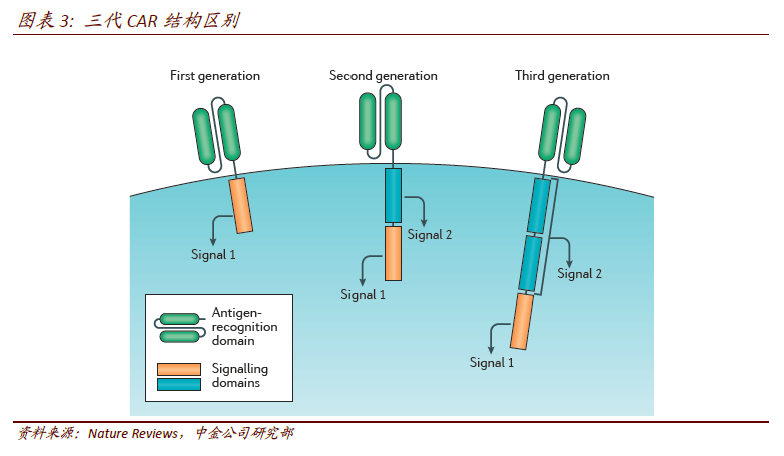
相比于TCR-T 細胞治療,CAR-T 不需要識別MHC 分子。由于CAR-T 克服了MHC 的限制性,可更有效的殺傷抗原特異性的腫瘤細胞,減少了由于腫瘤降低MHC 分子表達而造成的免疫逃逸,同時具備抗原抗體結合特異性好、親和力高的優勢。此外由于打破病人對于MHC 的限制后,CAR 改造的T 細胞相對于天然T 細胞表面受體TCR 能識別更廣泛的目標。
三代CAR 的區別。CAR 由胞外區、跨膜區和胞內區三個部分組成,其本質上是由不同蛋白功能結構域串聯形成的膜蛋白。胞外區通常是分離自抗原特異性單克隆抗體的scFv 片段,胞內是T 細胞活化的分子,如CD3ζ、FcRγ、CD28 或者41BB、FcRγ。第一代CAR 只有一個胞內信號組份,主要是CD3ζ或FcRγ,T 細胞可以被活化但無法增殖。第二代CAR具有兩個胞內信號組份,包括一個共刺激分子,如CD28、41BB 等。第三代CAR 具有三個胞內信號域,包括兩個串聯的共刺激域CD28、41BB 或OX40 和一個CD3ζ。目前研究表明三代CAR 使細胞具備更強的腫瘤裂解能力和分泌更多的細胞因子,在小鼠體內具有更強的腫瘤抑制能力。
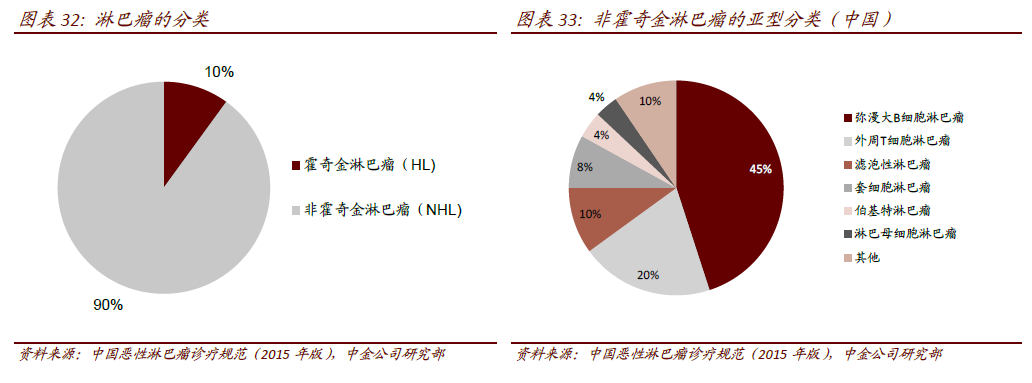
CD19 靶向的CAR-T 細胞在B細胞惡性腫瘤的治療中表現驚艷。在已有的CAR-T 治療中來看,靶向CD19 的CAR-T 細胞研究的最多也最成熟。全球范圍來看,已有多項CD19 靶向的二代CAR(CD28/CD3ζ)和三代CAR(CD28/CD3ζ/41BB)開展對非霍奇金淋巴瘤(NHL)、B-All(急性B 淋巴細胞白血病)、慢性淋巴細胞白血病(CLL)、濾泡性淋巴瘤(FL)、彌漫性大B細胞淋巴瘤(DLBCL)、套細胞淋巴瘤(MCL)等血液腫瘤的臨床試驗,且表現出優異的療效。以r/r B-All 為例,病人的完全應答率多為70~90%。2017 年ASCO 會議上,CAR-T 用于r/r MM(多發性骨髓瘤)中也取得令人矚目的效果,94%(33/35)患者在CAR-T 細胞輸注后2 個月內獲得了VGPR。CAR-T 細胞治療的出現,為晚期血液腫瘤患者帶來新的希望。