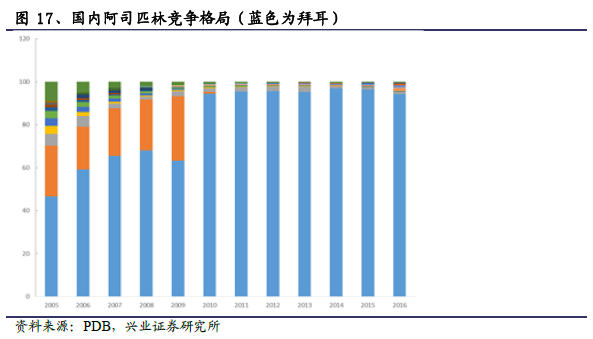
仿制藥多數品種批文較多,過度重復問題嚴重。根據SFDA相關數據,國內目前現存165050個國產藥品文號,估計其中約95%于2007年前發放,特別是在2002-2006年仿制藥申報高峰期,當時我國藥品審評標準對溶出度和參比制劑等標準非常寬松,由于CDE審評標準較低,企業往往抱著“占座”的心理進行申報,一些申報材料不完整、不規范、不真實,大量低水平的重復申報嚴重擠占了有限的審評資源,也導致了大量質量未經嚴格驗證的仿制藥存在于市面上。 根據SFDA對2014年11月25日前批準上市的共計2750個通用名品種化學藥品和生物制品的統計,其中21個品種均有超過100家生產企業產品上市流通,70個品種均有50—99家生產企業產品上市流通,282個品種已獲批準文號企業數多于20家且在銷批準文號企業數超過20家。另外90%以上的品種其CR10的集中度超過90%,說明同一品種有10家企業生產銷售即能基本滿足市場需求,但部分正常流通使用的藥品存在嚴重的過度重復問題。
一致性評價提高仿制藥集中度。根據《國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見》,化學藥品新注冊分類實施前批準上市的仿制藥,凡未按照與原研藥品質量和療效一致原則審批的,均須開展一致性評價。國家基本藥物目錄(2012年版)中2007年10月1日前批準上市的化學藥品仿制藥口服固體制劑,應在2018年底前完成一致性評價,其中需開展臨床有效性試驗和存在特殊情形的品種,應在2021年底前完成一致性評價;逾期未完成的,不予再注冊。化學藥品新注冊分類實施前批準上市的其他仿制藥,自首家品種通過一致性評價后,其他藥品生產企業的相同品種原則上應在3年內完成一致性評價;逾期未完成的,不予再注冊。通過一致性評價的藥品品種,在醫保支付方面予以適當支持,醫療機構應優先采購并在臨床中優先選用。同品種藥品通過一致性評價的生產企業達到3家以上的,在藥品集中采購等方面不再選用未通過一致性評價的品種。
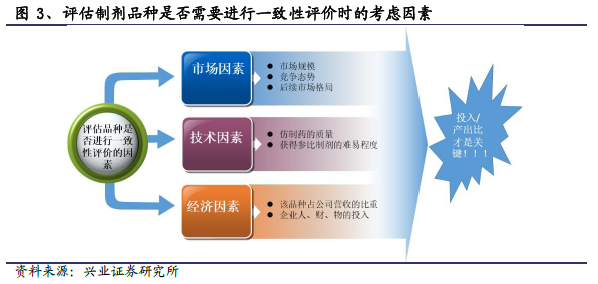
企業一致性評價評估中面臨的考量-技術、資金、市場等。從品種選擇上看,鑒于國內多數化藥制劑企業均有數量不一、獲批或在售的口服制劑及文號。若考慮到一致性評價的成本,對于多數企業來說必須要對旗下的品種進行取舍。決定某一品種是否進行一致性評價的因素主要包括以下幾方面:1)市場層面:該品種的市場規模、競爭態勢或后續市場格局;2)技術層面:一致評價的難易程度(自身產品的質量、參比制劑獲得的難易程度);3)經濟層面:企業所花費的人力、財力和物料成本等。可以預料的是,企業對于自身的主力產品(如泰嘉之于信立泰、阿樂之于嘉林藥業)是在一致性評價中必保的品種,對于部分競爭較為激烈、營收占比不大的品種很可能會放棄此次評價。因此,部分中小型企業相應的品種反而有望迎來機會。