ASO在細胞內發揮藥理作用主要分為RNase H1依賴型與空間位阻型兩種機制。(1)內源性RNase H1能夠特異性的識別RNA-DNA異雙鏈底物,當DNA為基礎的寡核苷酸與同源mRNA轉錄本結合并催化RNA的降解或ASO結合位點的剪切導致靶RNA的破壞,從而沉默靶基因的表達。這種方法已被廣泛用作下調致病或疾病修飾基因的手段。經典的RNase H1依賴型ASOs通常遵循Gapmer模式,即中心區域基于DNA、側翼區域基于經過化學修飾RNA的雜合單鏈寡核苷酸(如下圖a所示)。值得注意的是,RNase H1在細胞質和細胞核中都是活躍的,因此可以靶向細胞核內轉錄本,例如未成熟的pre-mRNA和長非編碼RNA,這可能是其他技術難以獲得的。(2)空間位阻機制的ASO可以掩蓋目標轉錄本中的特定序列,從而干擾mRNA、miRNA、Pre-mRNA或RNA蛋白的相互作用,即可上調基因表達也可下調基因表達。具體機制如下:首先,空間位阻ASOs最廣泛的應用是以選擇性地排除或保留特定的外顯子(分別為跳脫外顯子和包含外顯子),如下圖b所示;其次,ASO也可以通過靶向并掩蓋目標mRNA的AUG起始密碼子,從而中斷翻譯起始,如下圖c所示;第三,一些轉錄本包含上游開放閱讀框(uORFs),調節初級開放閱讀框(pORF)的翻譯活動。使用ASO靶向uORF會破壞這一調控,導致激活pORF翻譯,如下圖d所示;最后,轉錄本的穩定性可以通過改變剪切和聚腺苷酸化信號的使用來調節,例如針對遠端聚腺苷酸化信號的空間位阻ASO會優先使用較弱的近端聚腺苷酸化信號,由此產生較短、更穩定的轉錄本。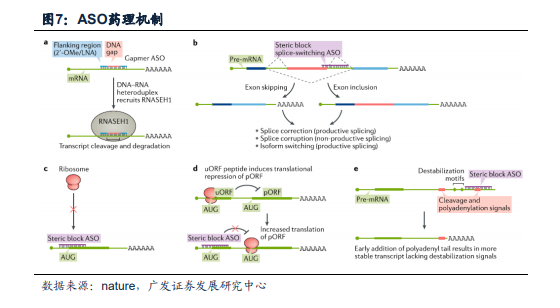
遞送系統及輔料的毒性。輔料中化學物質的毒性作用已經困擾了基于納米顆粒遞送系統的藥物開發,并且可能是導致許多相關候選藥物劑量限制毒性的主要原因,臨床試驗表明觸發因素可能直接來自輔料成分或輔料代謝分解,后者會隨著時間的推移而發生變化。此外,當細胞毒性確實發生時,難以確定確切的毒性成分可能是另外一個主要的挑戰。目前,臨床中研究的關鍵策略可能是將輔料限制在少量的化學成分中,這些化學成分單獨驗證是低毒性的,組裝的納米顆粒需要盡可能均勻,對改善藥物治療窗口和降低毒性有密切相關性。與此同時,納米顆粒制劑可能會隨著時間的推移而降解,并導致毒性增加,對試驗藥物的持續質量監測很可能有利于未來的試驗。最后,使用糖皮質激素和抗過敏藥物進行預處理已經大大減輕了基于納米顆粒遞送系統藥物的輸液反應。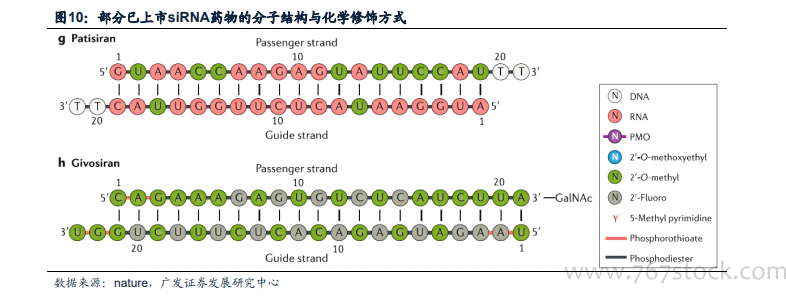
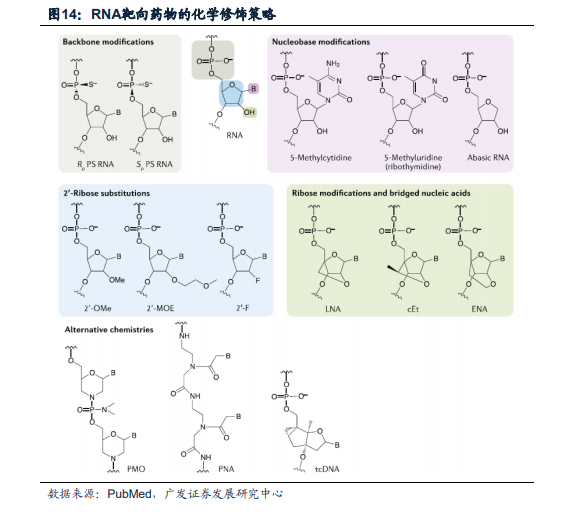
穩定性化學修飾提升藥物安全性與效力,大幅拓展藥物治療窗口。對于RNA靶向藥物而言,化學修飾(除了組織靶向配體)主要有兩個基本功能:首先,化學修飾可通過減弱細胞內源性免疫傳感器對dsRNA的免疫反應,大幅提高藥物的安全性。其次,通過增強RNA藥物抵抗內源性內切酶和外切酶降解的能力,大幅提升藥物療效。針對siRNA藥物,化學修飾還可以增強其反義鏈對RISC負載的選擇性,提高序列選擇性以降低脫靶RNAi活性,改變物理和化學性質以增強遞送能力。通過特定的化學修飾可提高藥物安全性、代謝穩定性、靶向性、結合親和力和沉默效果,大幅拓展了藥物的治療窗口,因此化學修飾的絕對必要性在RNA靶向藥物的臨床開發早期挫折中已經得到了充分證明。迄今為止,FDA批準的所有RNA靶向藥物都是化學工程的RNA類似物,支持了化學修飾的效用。