到 2003 年,已有多家公司致力于 RNAi的治療領域。不幸的是,使用未修飾的 siRNA的第一批臨床試驗導致了免疫相關毒性和可疑的 RNAi 效應。隨后為了減少核酸酶對于未修飾 RNA 的降解作用,頭部企業脂質體等納米制劑對 siRNA 進行遞送。雖然使用了新的遞送系統的 siRNA 在臨床試驗取得了重要進展,例如首次確認全身施用的納米顆粒對人類的 RNAi 效應,但受制于當時載體系統技術仍不成熟,siRNA 納米顆粒顯示出了明顯的劑量限制性毒性和不足的治療效果。結果,大型制藥公司在 2010 年初退出了 RNAi 領域,給該行業帶來了資金危機。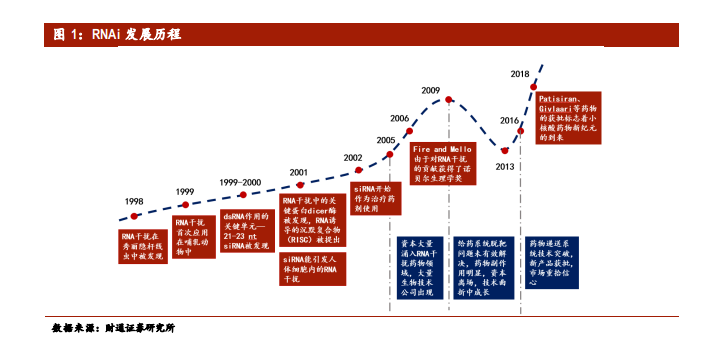
經過多年沉寂,RNAi 領域進入新紀元。盡管存在這些挑戰,規模較小的 RNAi 公司和學術研究人員仍吸取了先前臨床試驗失敗的慘痛教訓,并堅持不斷改進序列選擇、核苷酸化學修飾和遞送機制。這些實質性進展,加上對疾病適理解的深入,更成熟的臨床開發過程和更強的制造能力,開拓了一條更安全、有效的 RNAi 治療途徑。2016 年以來,多款 ASO(反義寡核酸)藥物陸續上市給了行業一定信心,但由于 Ionis 藥品很多機理尚不明確,產業界仍有質疑。而 2018 年 8 月 10 日,美國 FDA 批準了作用于肝臟的 siRNA 藥物 patisiran(Onpattro),以治療遺傳性疾病轉甲狀腺素蛋白淀粉樣變性病(hATTR)。 Patisiran 的批準為醫療需求未得到滿足的hATTR 患者帶來了新希望,真正預示著 RNAi 治療領域新紀元的到來。
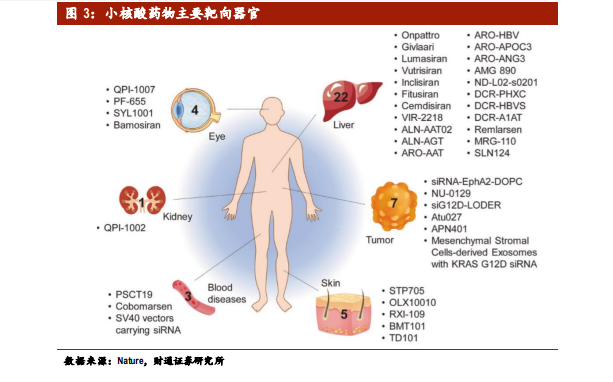
小核酸藥物治療的靶器官主要受遞送系統影響,肝腎等器官是載體天然易被動集聚的器官,針對肝臟,腎臟和眼部適應癥的多種候選藥物目前正在 I,II 和 III 期臨床試驗中,并且針對中樞神經系統(CNS)和其他非肝臟組織的研究性新藥(IND)應用有望實現。