藥品審評審批新政的逐步推進,在促使國產品種審評加速的同時,亦利好于外資品種。已上市藥品境外臨床試驗數據無人種差異可直接申報上市、即到即審等新規也為外資創新藥加速獲批創造良機。以近年來獲批上市/進口的生物藥審評時長為例,治療用生物制品的審評時長已經從2013年超過1600天逐步壓縮到不到300天的水平,審評速度和效率有了顯著提升。而從外資進口品種角度來看,大部分品種審評時長亦都在300天以內,少數品種甚至已不足100天。
除了審評時長縮短,國內與國際獲批時間的“時差”亦在顯著縮短。過去,由于進口藥進入臨床二期才能在國內提交申請、國內知識產權保護不完善、審批人員不足等原因,進口藥在國內上市進程緩慢。受制于審評速度,國內的上市時間往往晚于國外數年之久,以AbbVie的重磅藥物修美樂為例,FDA早在2002年12月就批準其在美國上市,而在中國的獲批時間為2010年2月,整整滯后86個月。而從2018年來看,這種情況已出現一定的改善。以表3列舉的部分品種為例,滯后的時間差已縮減至50個月以內。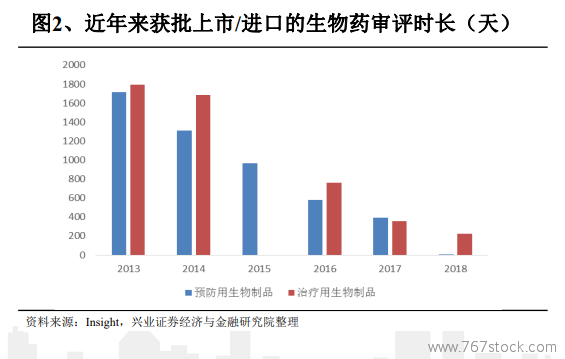
而在近期剛塵埃落定的2019版談判目錄中,雖然出于保護外資品種全球價格體系而致使大部分外資品種并未披露具體的價格和降幅,但從公布的少量品種結果來看,降價均幅亦在65%以上。誠然,通過取消贈藥方案可以為降價帶來緩沖,但無論是縱向比較,參考外資品種過去在中國的降價行為;還是橫向比較,參考外資品種對全球價格體系的維護,外資品種在歷次談判中的參與積極性和降價力度均是歷史未見、國際少見的。例如阿達木單抗,此次談判后的價格降至1290元(0.8ml:40mg),而對比海外,在美國的售價約為2600美元(歐洲部分地區價格在1000美元以下)。