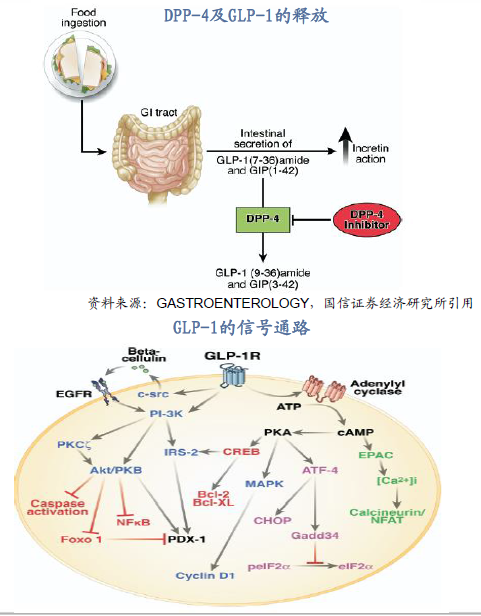
各類SGLT-2抑制劑接連獲批,降糖藥市場競爭或加劇。2017年3月阿斯利康的達格列凈獲得CFDA批準上市,成為中國批準上市的首個SGLT-2抑制劑,同年9月,勃林格殷格翰的恩格列凈、西安楊森的卡格列凈上市申請亦接連獲批。17年12月, FDA批準默沙東埃格列凈(Ertugliflozin)上市,其為美國批準的第4個、全球第七個SGLT-2i。SGLT-2抑制劑憑借其特異性抑制肝糖原再吸收以及潛在的心血管獲益受到患者的青睞,國內國際降糖藥市場競爭愈發激烈。
SGLT-2抑制劑首次納入治療指南,在口服降糖藥中存在優勢。中華醫學會糖尿病學分會(CDS)組織編寫的《中國2型糖尿病防治指南》于2018年1月發布。其中,鈉-葡萄糖協同轉運蛋白2抑制劑(SGLT-2i)作為新型降糖藥首次治療路徑內,并對于二甲雙胍單藥治療血糖控制不佳的患者,可早期聯合SGLT-2i治療。根據指南,SGLT-2i的降糖效果與二甲雙胍相當,且有心血管增益,單獨使用不增加低血糖風險,存在優勢。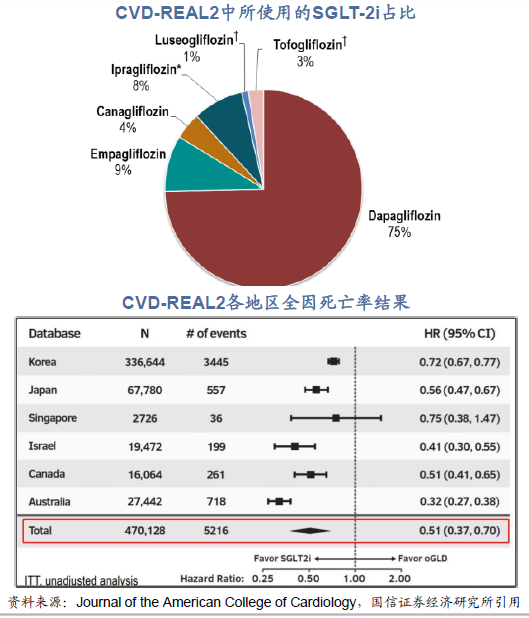
賽諾菲新型SGLT-1/2雙效抑制劑Sotagliflozin在歐盟進入正式審查。Sotagliflozin由美國藥企Lexicon 研制,賽諾菲于2015年11月與其達成17億美元授權協議,獲得了除日本外的全球獨家權利。今年3月,賽諾菲同時向歐盟EMA和美國FDA提交了Sotagliflozin用于治療一型糖尿病(T1DM)的監管申請文件。在In Tandem臨床研究中除了展現降血糖療效,Sotagliflozin還表現出了顯著減輕體重的效果。若Sotagliflozin成功獲批,將成為除胰島素外治療T1DM的首個新型藥物。
大型心血管實驗CVD-REAL2公布研究結果,為SGLT-2i再添“心”證據。CVD-REAL2研究是SGLT-2i在真實世界的回顧性隊列研究,納入韓國、日本等六個國家共47萬例2型糖尿病患者,并首次大幅納入亞洲人種(86.6%為亞洲人群)。第67屆美國心臟病學學會年會(ACC 2018)上公布了CVDREAL2研究結果,SGLT-2i組可顯著降低患者的CVD事件發生率(全因死亡率下降49%、心肌梗死下降19%、卒中下降32%、所有P值均≤0.001),借此SGLT-2抑制劑類藥物的心血管增益獲得強有力證據支撐。
恩格列凈獲批新適應癥,為首個獲批心血管增益的降糖藥。2016年12月,FDA宣布基于一項涵蓋7000名2型糖尿病患者的上市后臨床研究EMPA-REG OUTCOME的研究結果,批準恩格列凈的新適應癥:用于降低患二型糖尿病合并心血管疾病成人患者的心血管死亡風險。恩格列凈成為首個在臨床試驗中顯示可提供心血管獲益的口服降糖藥。