我國醫藥工業是以仿制藥為主導的行業,但總體屬于低仿制水平,劣質或過剩產能亟需淘汰。目前我國通過GMP 的藥企有5000 多家,絕大多數是仿制藥企業,“小、散、亂”的現象比較突出。截止2016 年底國家藥品食品監督局共批準18.9 萬個藥品批文,但實際生產銷售的批準文號只有4 萬-5 萬個,意味著三分之二以上的文號是沒有實際生產的“僵尸文號”。大量國產仿制藥屬低水平仿制,與原研制劑相比安全低效甚至無效。因此,國家推出一致性評價政策的初衷也是為了淘汰過剩產能,淘汰僵尸批文,提高行業集中度以及行業利潤率,最終促進醫藥行業發展。
更進一步,推行一致性評價利于推進供給側結構性改革。產品質量是供給側問題,是如何更好地滿足市場需求的問題,也是結構性問題。仿制藥質量提高了,臨床上實現與原研藥相互替代,就能夠推動藥品生產領域的結構性改革,改變現在原研藥在有的大醫院藥品銷售比達到80%的局面,有利于降低醫藥總費用支出,有利于淘汰落后產能,提高仿制藥的競爭力。醫藥企業通過開展仿制藥一致性評價,也有利于創新。制劑是有效成分、輔料和包材的有機結合,一致性評價將促進企業更多地進行生產工藝和輔料、包材的綜合研究,全面提高制劑水平。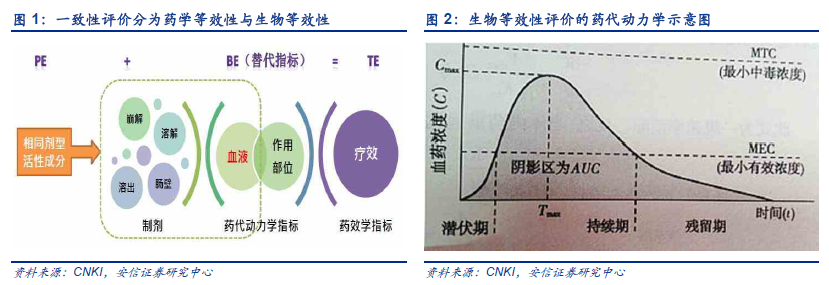
仿制藥一致性評政策實施的目的在于仿制藥與專利藥相比治療等效(Therapeuticequivalence,TE),可互相替代,一致性評價是仿制藥上市的基礎,從而免去大規模臨床試驗和研究。藥物制劑要產生最佳療效,其藥物活性成分應當在預期時間段內釋放吸收并被轉運到作用部位達到預期的有效濃度。大多數藥物是進入血液循環后產生全身治療效果的,作用部位的藥物濃度和血液中藥物濃度存在一定的比例關系,因此可以通過測定血液循環中的藥物濃度來獲得反映藥物體內吸收程度和速度的主要藥代動力學參數,間接預測藥物制劑的臨床治療效果,以評價制劑的質量。
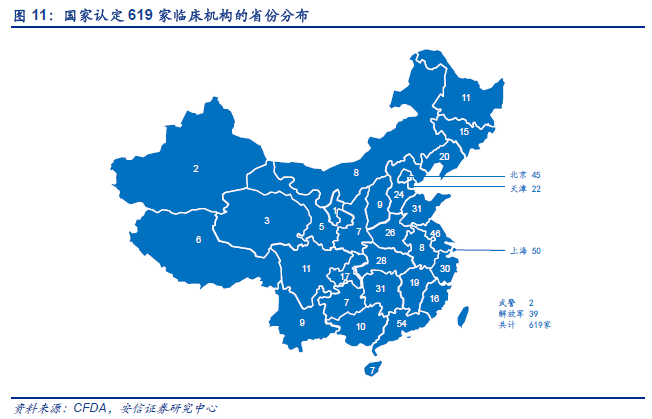
為什么首先要對基本藥物目錄中的化學藥品口服固體制劑進行一致性評?我們認為主要有以下兩點原因:一是因為口服固體制劑量大面廣、最為常用;二是基本藥物是保障群眾基本用藥需求的品種。根據CFDA 初步統計,2007 年10 月前批準上市的化學藥品仿制藥口服固體制,在基藥目錄中有289 個品種、17740 個批準文號或注冊證號,涉及1817 家國內生產企業、42 家進口藥品企業。
一致性評價相關政策逐步完善并落實到位,2018 年即將步入收獲期。2012 年國務院發布《國家藥品安全“十二五”規劃》,拉開了國內仿制藥一致性評價的序幕,但當時相關配套政策以及條件不夠成熟,一致性評價進展相對緩慢。