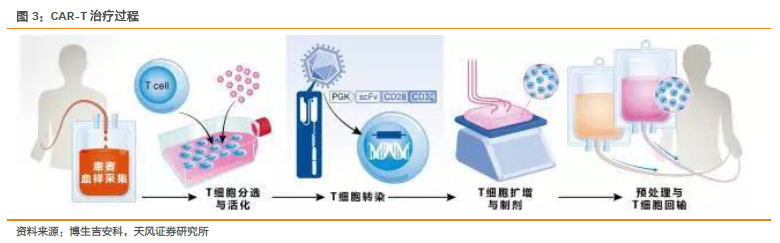
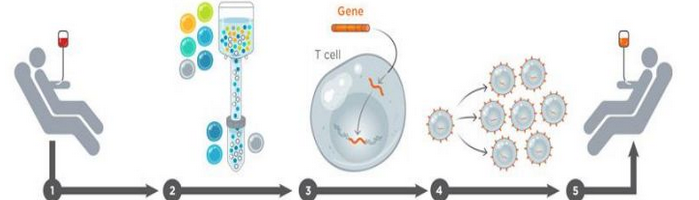
海外產品上市進度加速,兩款CAR-T產品已獲FDA批準。2017年,FDA批準CAR-T上市,提振科學界、患者、臨床醫生對于免疫細胞治療領域的強大信心。8月30日,諾華的Kymriah率先獲批上市,獲批適應癥是兒童和年輕成人急性淋巴細胞白血病(ALL),定價47.5萬美元,并承諾無效退款。10月18日,Kite的Yescarta第二個獲得FDA批準上市,適應癥與諾華的不同,為成人復發或難治性大B細胞淋巴瘤,定價為37.3萬美元。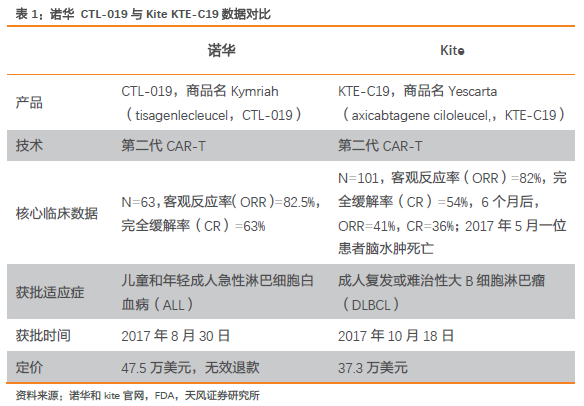
國內政策先行,行業迎來新時代。國內加速追趕的腳步,2017年以來,陸續發布多項關于免疫細胞治療的重磅政策,規范指導國內相關企業產品研發、注冊、上市,政策紅利將帶來行業變革。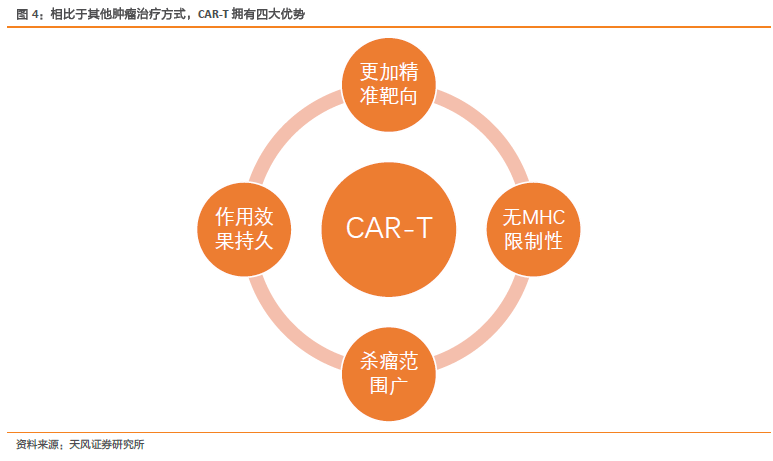
回顧我國細胞治療行業歷史,經歷亂象叢生到規范化發展的過程。早期部分科室存在違規開展臨床治療,行業亂序發展。回顧政策發展歷史,2009年,衛生部免疫細胞治療技術列入第三類醫療技術,由于當時免疫細胞治療手段的安全性、有效性尚需經規范的臨床試驗研究進一步驗證,因此需要衛生部第三類醫療技術審核機構技術審核通過后才能開展臨床試驗。據新京報報道,我國批準的細胞免疫治療的臨床試驗項目非常少,原國家食品藥品監督管理局只批準過兩個地方項目:一個是北京大學人民醫院陸道培院士的CIK臨床項目,還有曹雪濤院士樹突狀細胞(DC)項目。其他的地方醫院進行的細胞免疫治療臨床試驗,并沒有經過批準。實際上,2015年國家第三類醫療技術應用管理政策調整之前,國家衛計委也并沒有批準過任何醫療機構開展免疫細胞技術的臨床應用,但是全國范圍內仍然有科室違規開展免疫細胞治療技術對患者進行治療。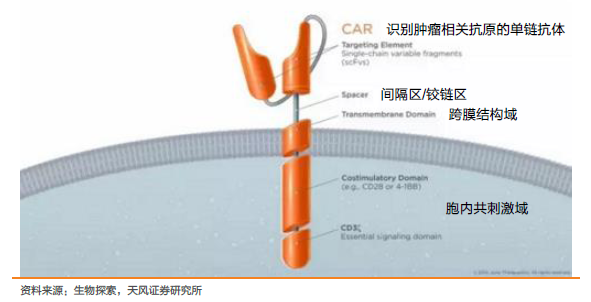
腫瘤免疫療法再獲突破,誕生劃時代產品CAR-T。腫瘤免疫療法是當前研發熱點之一,CAR-T是一項具有劃時代意義的突破技術。2011年,美國賓夕法尼亞大學Carl H. June 教授團隊的 CAR-T 療法在1例慢性淋巴細胞白血病(CLL)患者治療的中獲得突破,2012年,June團隊使用CAR-T治療急性淋巴細胞性白血病(ALL)7歲患者Emily,經歷連續高燒后,達到完全緩解,今年12歲,已健康生活了5年。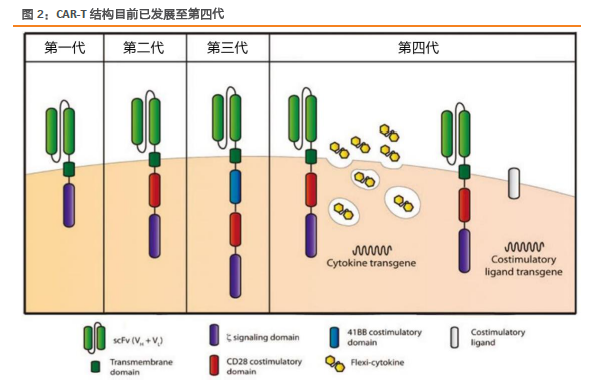
腫瘤免疫治療優勢明顯,漸成抗癌新星。攻克癌癥一直是人類永恒的課題,人類對癌癥的治療方法從手術治療、放射線治療、化學治療,發展到較為先進的靶向藥物治療,取得了一系列長足進步,然而這些治療方法仍然存在不同程度的局限性,相比而言,免疫治療作為新興的治療方式,具備治療效果明顯、毒副作用小、作用范圍廣泛,通過調動機體自身的免疫力量達到抗腫瘤作用,可以持久響應等優勢。