在 LUMMICAR 研究中,共有 14 位受試者(34 到 62 歲,中位年齡:54 歲)接受了 CT053 注射治療。其中,3 名受試者接受 1.0×108劑量的 CAR-T 細胞治療,11名受試者接受了 1.5×108 個 CAR+T 細胞。截止到 2021 年 7 月 8 日,中位隨訪時間為 13.6 個月。所有的受試者均經歷了≥3 級的中性粒細胞減少,91.7%的受試者經歷了≥3 級的血小板減少,但大多數在 2 周內恢復到≤2 級。試驗期間沒有劑量限制性毒性或治療相關死亡的報告。此外,沒有觀察到≥3 級 CRS 或神經毒性,92.9%的受試者經歷了 1 級或 2 級 CRS。除 1 例 3 級肺部感染外,沒有嚴重感染的報道。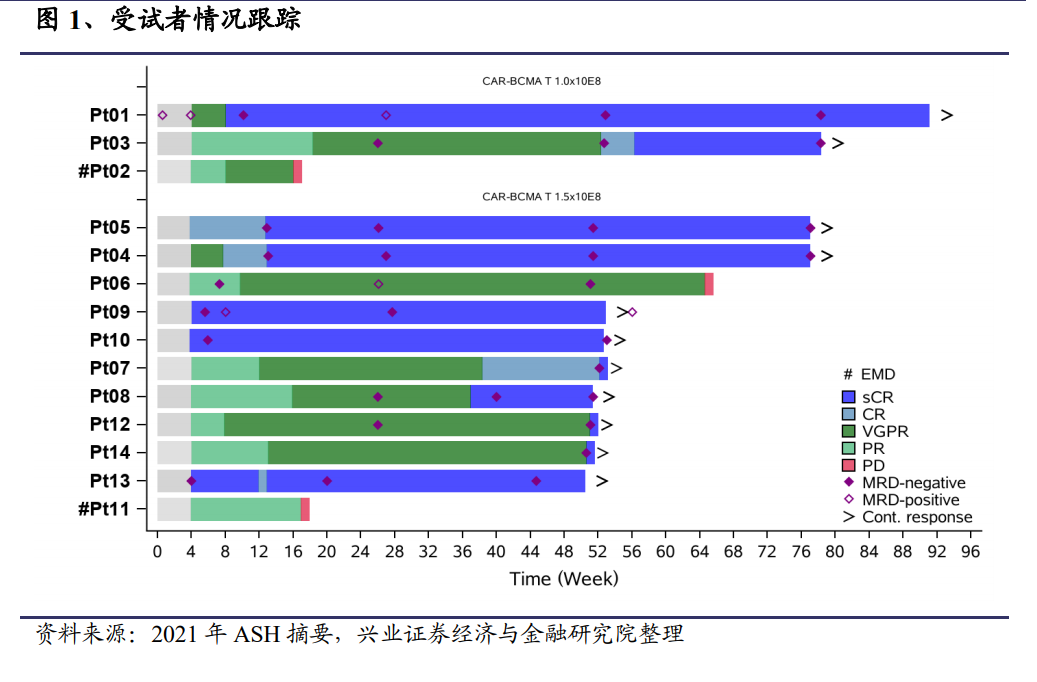
14 名受試者達到 100%總緩解率(ORR),其中 11 名嚴格完全緩解(sCR,78.6%),2 名非常好的部分緩解(VGPR),1 名部分反應,≥VGPR 率為 92.9%。截至 2021年 7 月 8 日,12 名受試者仍在研究中,無進展生存(PFS)率為 85.7%。隨訪的中位數為 13.6 個月,尚未達到反應持續時間中位數和 PFS 中位數。沒有髓外疾病的受試者的 CR/sCR 率為 91.7%,其 1 年 PFS 率達到 100%。這些結果表明,CT053 CAR T 細胞在 1.0-1.5×108 個細胞的劑量下,可實現深度和持久的反應,包括高的 MRD 陰性 sCR 率,并且在重度預處理的 RRMM 患者中具有可接受的安全性。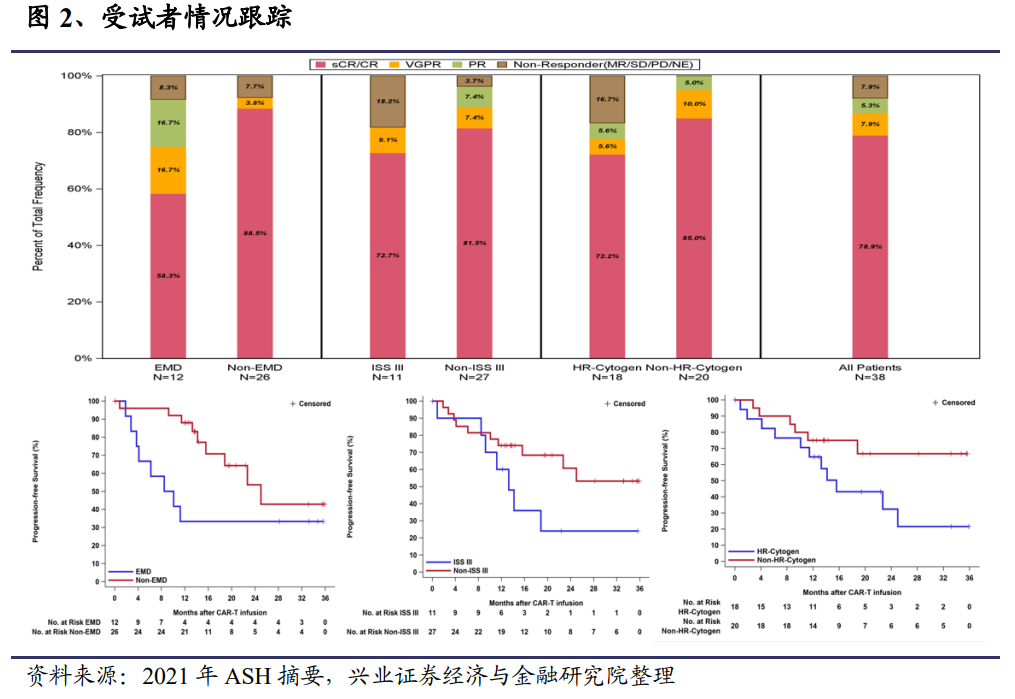
復發或難治多發性骨髓瘤患者在真實世界中接受標準治療的預后。共有 112 名患者的 237 條符合條件的治療線被納入分析;中位隨訪時間為 16.6 個月。在啟動的治療線中,45%的患者對 4 種或 5 種療法難治,62%的患者之前接受過≥5 種治療線,22%的患者患有髓外疾病,在 48%的觀察中,之前治療線的進展時間短于 4 個月。在患者成為三期暴露后,開始了 50 多種獨特的治療方案,以下是最常見的:卡非佐米+地塞米松(14%),泊馬度胺+地塞米松+化療(8%),以及伊沙佐米+來那度胺+地塞米松(6%)。此外,4%的納入觀察對象接觸了抗BCMA 藥物。


