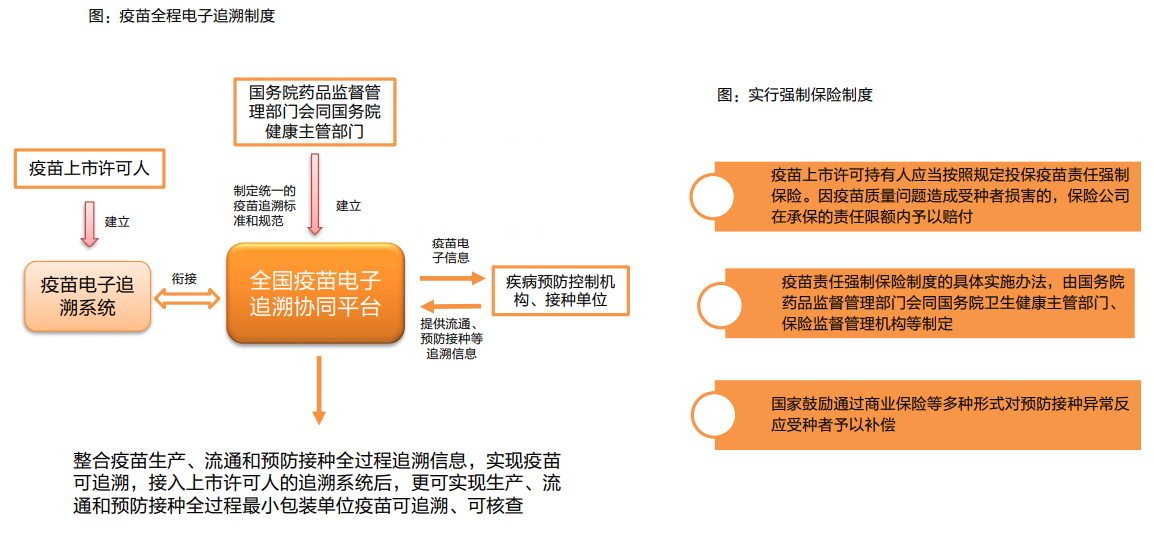
長生疫苗等事件促使疫苗管理立法:長生生物事件后,對疫苗單獨立法排上日程,2018年9月,中央全面深化改革委員會會議審議通過《關于改革和完善疫苗管理體制的意見》,提出嚴格市場準入,強化市場監管,優化流通配送,規范接種管理,堅決堵塞監管漏洞,嚴厲打擊違法違規,確保疫苗生產和供應安全。要發揮國有企業和大型骨干企業的主導作用,加強疫苗研發創新、技術升級和質量管理。2019年6月《中華人民共和國疫苗管理法》經人大常委會議表決通過,12月1日起施行,從立法的高度,未來將對疫苗從研發、生產、流通和使用全鏈條、全周期實施強監管。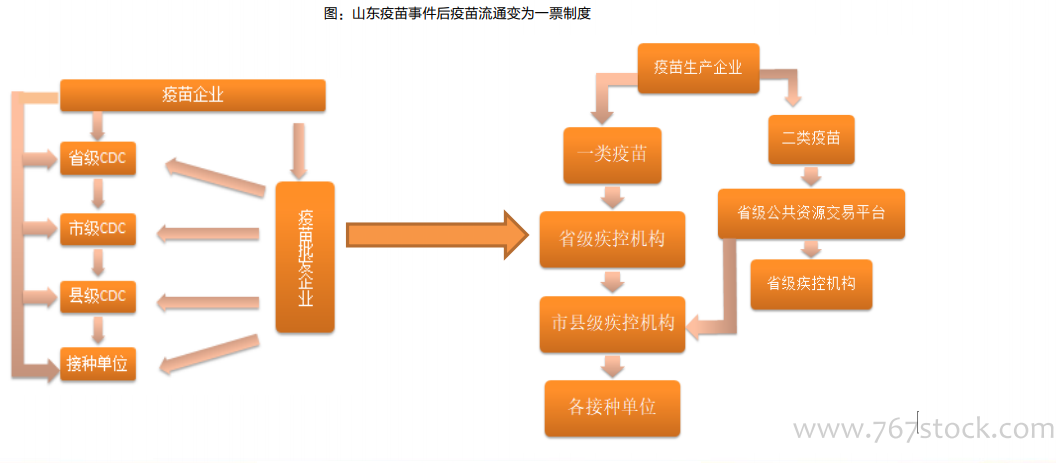
我國已有四款疫苗通過WHO預認證,后續預計將有更多產品走出國門:截止目前,成都生物制品研究所生產的乙型腦炎減毒活疫苗、北京北生研生物公司生產的口服Ⅰ型Ⅲ型脊髓灰質炎疫苗、華蘭生物公司生產的流感疫苗、北京科興生物公司生產的甲型肝炎滅活疫苗等先后通過了世界衛生組織預認證,并被納入聯合國兒童基金會、全球疫苗免疫聯盟采購計劃,標志著中國疫苗走向世界,隨著政策的鼓勵,預計后續更多的國產疫苗有望走出國門,造福世界。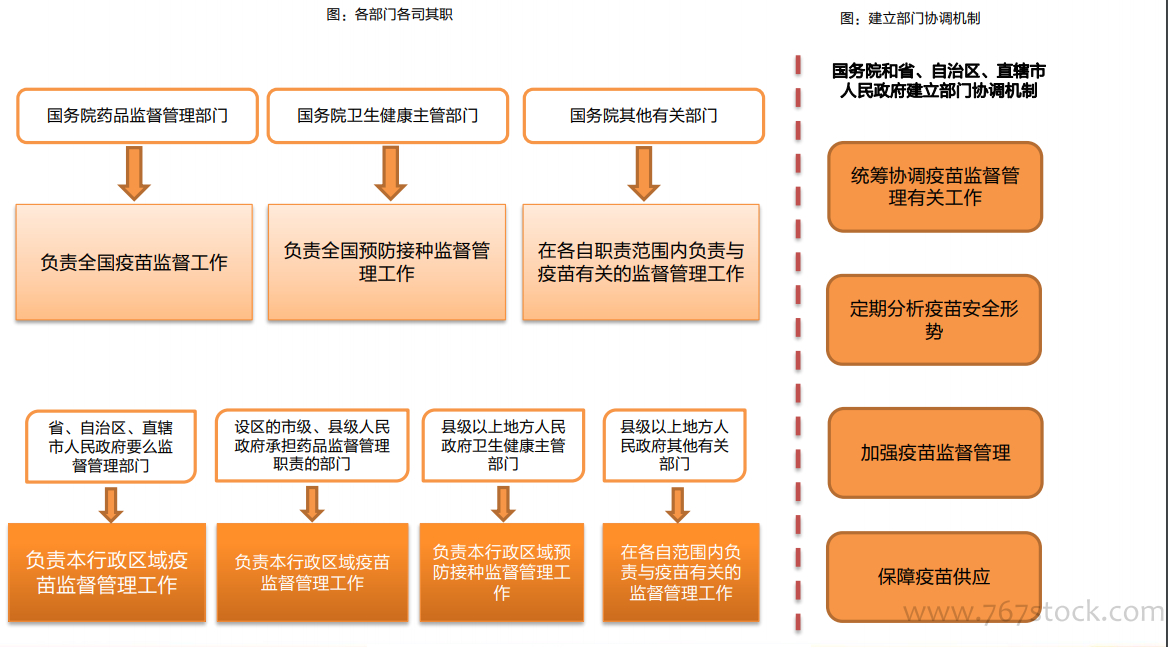
立法高度規范和支持疫苗行業發展:《疫苗法》從立法的高度,對疫苗從研發、生產、流通和使用全鏈條、全周期實施強監管,堅決堵塞監管漏洞,嚴厲打擊違法違規,確保疫苗生產和供應安全,有利于行業規范健康的發展;國家制定疫苗產業發展規劃和產業政策,支持疫苗行業的持續發展。國家政策的監管和支持有望為疫苗行業的健康持續發展保駕護航。