去品牌化趨勢確立,擁抱通用名藥物新時代。隨著配套政策的逐步明晰,仿制藥一致性評價工作真正進入了快速推進階段。2017 年11 月29 日,CFDA 核查中心正式啟動了首批7 個品種的仿制藥一致性評價品種現場檢查工作,6 個檢查組分別奔赴北京、重慶、浙江、江蘇、湖南、江西等省、直轄市。參考CFDA 100號文(總局關于仿制藥質量和療效一致性評價工作有關事項的公告)中“45 日內完成立卷”、“有因檢查工作一般在立卷審查結束后60 日內完成”、“審評工作一般應當在受理后120 日內完成”的規定,并結合首批品種的受理/承辦時間主要發生在9 月,我們判斷首批通過仿制藥一致性評價的品種有望于2018 年一季度(或之前)產生。
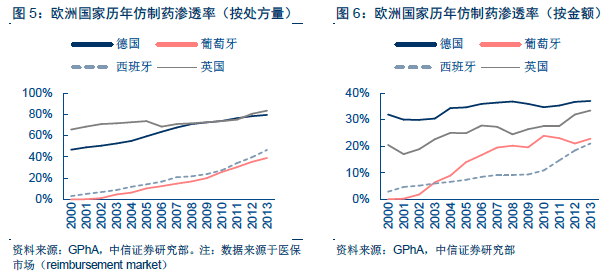
他山之石:醫保支付模式深刻影響美日通用名藥物發展。在全球范圍內,藥品大致分為品牌藥和仿制藥兩大類,品牌藥一般指處于專利期內的創新藥物,而仿制藥大多是無品牌仿制藥,即通用名藥物。過去幾年,通用名藥品在全球范圍內迅速較快,處方量占比逐年提升。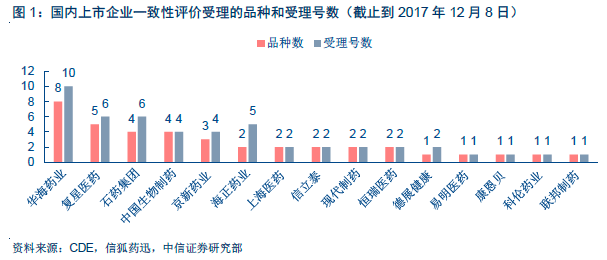
美國:通用名藥品發展的典范,處方占比超過80%。美國擁有全球最大的仿制藥市場,2014 年處方占比已高達88%,且其中主要為無品牌仿制藥(82%),品牌仿制藥的占比較小(6%)。20 世紀60 年代,受到反應停事件影響,美國頒布《Kefauver-Harris Drug Control Act》法案,規定新藥申請必須包含藥物有效性和安全性證明,同時對于1938-1962 年間已經上市的品種啟動藥效再評價項目(Drug Efficacy Study Implementation,DESI),最終3443 個品種中,有2225 個(64.6%)被證明有效,1051(30.5%)個無效,167(4.9%)個無結果。新的藥品申請法案和藥效再評價項目從增量和存量兩個維度大幅提高了美國仿制藥的安全性和有效性。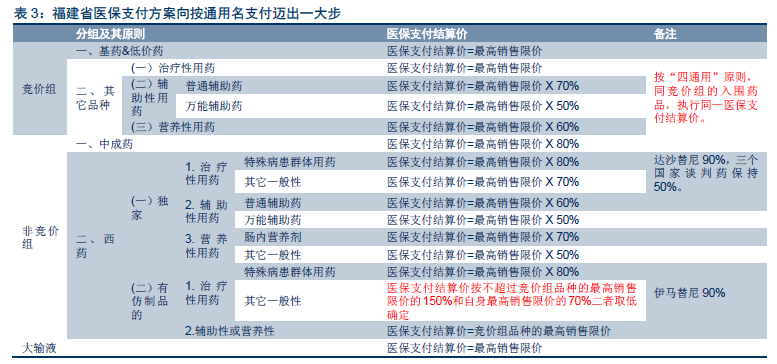
日本:醫保等比例支付,通用名藥發展較慢。與美國通用名藥物較高的市場滲透率相比,日本的通用名藥物發展則較慢。2005 年,美國的通用名藥物占比已經超過了50%,而日本尚不足20%。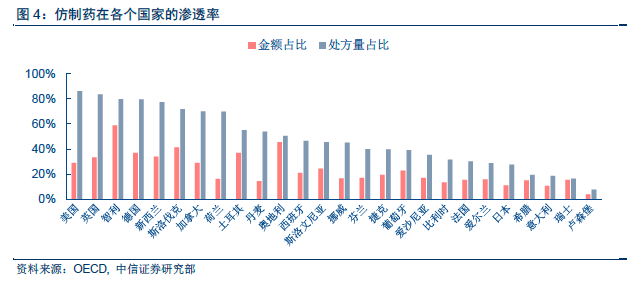
國內:我國制藥行業迎來量價雙重變革。回顧美國、日本的發展歷史,我們發現兩國為了推動通用名藥物的發展,都實施了藥品上市后質量的再評價,以保障通用名藥品的質量和療效。但兩國在醫保支付的模式上卻顯著不同:美國由于以商業保險為主導,商保機構有著更強的逐利性質,為了鼓勵使用通用名藥品以節省醫保費用,其在通用名藥物和原研藥之間設置了較大的自費差異;而日本的保險以社會保險為主導,藥品的報銷是按照等比例進行支付,導致通用名藥物和原研藥直接的自費金額差距較小,患者也對這種程度的價格差距不敏感。我們認為美國和日本醫保支付方式的差別是兩國通用名藥物發展迥異的重要原因。