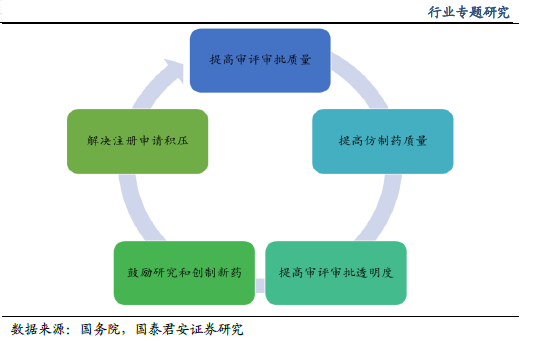
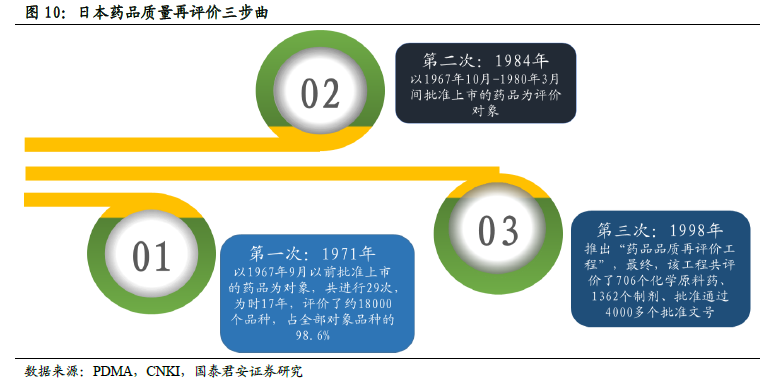
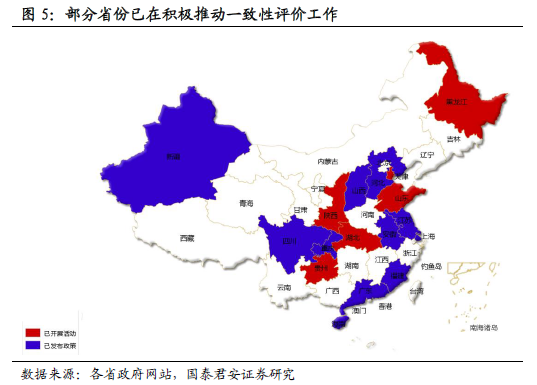
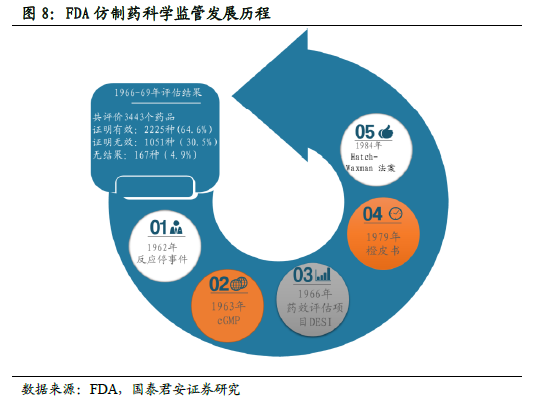
這是次國家 戰略的強勢推進。本輪仿制藥一致性評價的顯著特征是:重視高(高層領導重點關注)、力度大(頂層文件陸續出臺)、進度快(平均2 周一項落實細則出臺)。我們認為一致性評價作為醫改的重要“配套”政策,同時也是藥品注冊改革的關鍵環節,已上升到國家戰略高度,預計推進力度有望超越市場預期。本次一致性評價涉及的品種潛在范圍超過8 萬個批文,如切實貫徹執行,或將成為中國制藥工業發展的分水嶺。
這是一次規定時限的高難度動作。時間緊:首先,要求2007 年10 月1日前批準的國家基本藥物口服制劑需在2018 底之前完成。任務重:僅前述有明確政策時限的就有近300 個品種,涉及到1883 家企業,批文數約1.8 萬個。難度大:國內制藥企業基礎研究較為薄弱,在參比制劑和藥學評價上大多需從零開始,再考慮到臨床資源不足,產能瓶頸明顯,預計整個一致性評價工作需要5-10 年的時間才能完成。
這是一次醫藥行業的變革起點。①國內制劑企業:單品種500 萬+的一致性評價費用使得企業成本大幅增加,而當下醫改政策“降價控費”又對產品價格形成壓制——我們預計未來3 年內將是制藥工業“收入承壓+成本上升”的“陣痛期”。隨著相當部分中小企業或被迫退出,擁有品種整合能力的企業將受益于集中度提升,有望在陣痛后形成強者恒強、合縱連橫的新局面,未來的競爭格局將大為優化。②制劑出口企業:三條政策優惠保駕護航,在艱難走出國門后,制劑出口企業迎來榮歸故里搶占市場份額的新機遇。③CRO 行業:預計未來3-5 年有望累計增加100-300 億元規模,本次一致性評價需要大量的藥學研究和臨床研究的高效結合,綜合服務能力將是關鍵競爭要素。④藥用輔料行業:藥用輔料是前期藥學評價的重要影響因素,積極參與下游制劑企業一致性評價工作的龍頭公司將占據先發優勢。