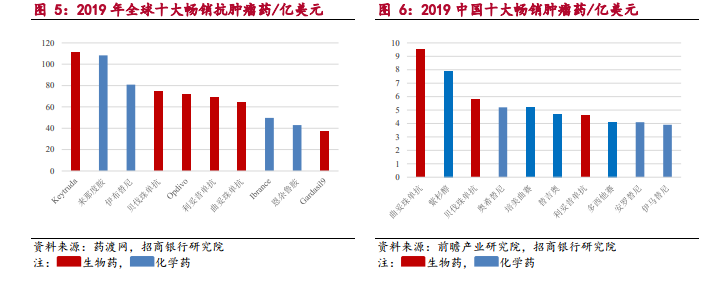
政策支持推進,促使醫藥行業未來更加規范化和集中化,鼓勵創新。另一方面,隨著藥包材藥用輔料與藥品關聯審評審批、藥物研發與技術審評溝通交流會、優先審評、MAH、加入國際 ICH以及加快建立 eCTD系統等一系列政策支持推進,促使醫藥行業未來更加規范化和集中化,鼓勵創新并與國際接軌。CDE 近年審評報告顯示,藥物審評堆積情況大大緩解,從巔峰的 22000 件堆積降至 4000 件左右。創新藥的申請也在逐年增加。一方面,國產創新藥研發依舊呈現化學小分子藥為主,生物大分子藥為輔的局面。另一方面,對比 2014年和 2019 年數據,生物創新藥在總體創新藥申請中占比已經由 6%躍升至 24%,生物創新藥的重要性日益突出。從治療領域區分,2019 年 NMPA 新藥臨床申請適應癥占比中,抗腫瘤藥物占據申請的一半以上,該賽道已經成為創新藥研發中最受重視,競爭最激烈的賽道。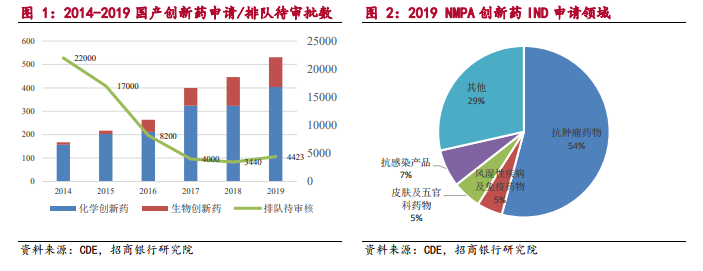
惡性腫瘤發病率死亡率逐年攀升,創新藥物需求增加。我國目前是世界上惡性腫瘤年發病率最高的國家,且發病率和死亡率均逐年上升。2015年發病中標率為 190.64/10 萬,高于世標率 186.39/10 萬。隨著我國經濟的進一步發展,內陸城市 PM 2.5 不斷增長,短期內,我國的腫瘤發病率還將持續高位增長。在疾病發病率和死亡率不斷攀升的雙重壓力下,尋求積極有效的創新療法需求不斷增加。
對比發達國家,預后較好的腫瘤 5 年生存期存在差距,驅動抗腫瘤創新藥進口與研發。2015年,我國惡性腫瘤的 5年相對生存率約為 40.5%,相比 10年前提高了 10%左右,但與發達國家相比仍有很大差距。即使在預后較好的腫瘤如乳腺癌、甲狀腺癌和前列腺癌等疾病中,患者 5年生存率為 82.0%、84.3%和66.4%,也與美國相去甚遠(90.9%、98%和 99.5%)。一方面是由于我國高發癌種與歐美發達國家有差異,國人體檢意識較差,疾病發現已到晚期。另一方面也是由于治療藥物種類比較稀缺,疾病后期選擇范圍較少,晚期病例臨床診治不規范。