激酶是催化高能供體分子(如ATP)將磷酸基團轉移到特定底物的酶。激酶大致可分為四大類:蛋白激酶、脂肪激酶、果糖激酶和突變型激酶,包含CK1、AGC、CAMK、CMGC、GYC、TK、TKL、STE、Atypical等。蛋白激酶是關鍵的酶家族,能夠催化蛋白質的磷酸化過程,該過程是神經信息在細胞內傳遞的最后環節,可導致離子通道蛋白及通道門的狀態變化。激酶介導的信息傳遞途徑的異常調節可導致癌癥、心血管疾病、神經退行性疾病、代謝紊亂等多種重要疾病。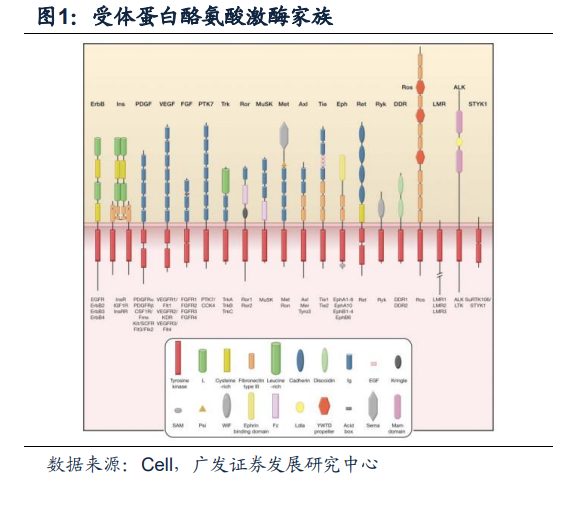
蛋白酪氨酸激酶(Tyrosine Kinase, TK)可分為受體型(receptor tyrosinekinases,RTKs)與非受體型(non-receptor tyrosine kinases),兩種類型都能夠催化ATP上γ-磷酸基團轉移至蛋白酪氨酸(Tyr)殘基上并使其磷酸化。這一過程在細胞信號傳導通路中占據十分重要的地位,在細胞的生長、分化、代謝、死亡等過程中起著關鍵性的作用。人類基因組中,共有58種受體型和32種非受體型。受體蛋白酪氨酸激酶常見的包括EGFR、PDGFR、FGFR、VEGFR、NGFR等,非受體酪氨酸激酶包括JAK等。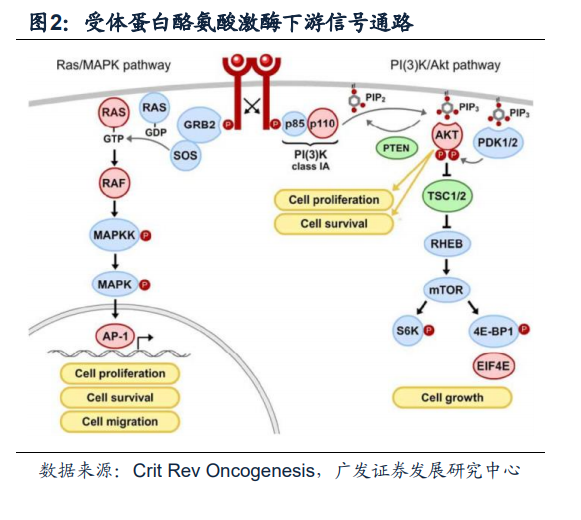
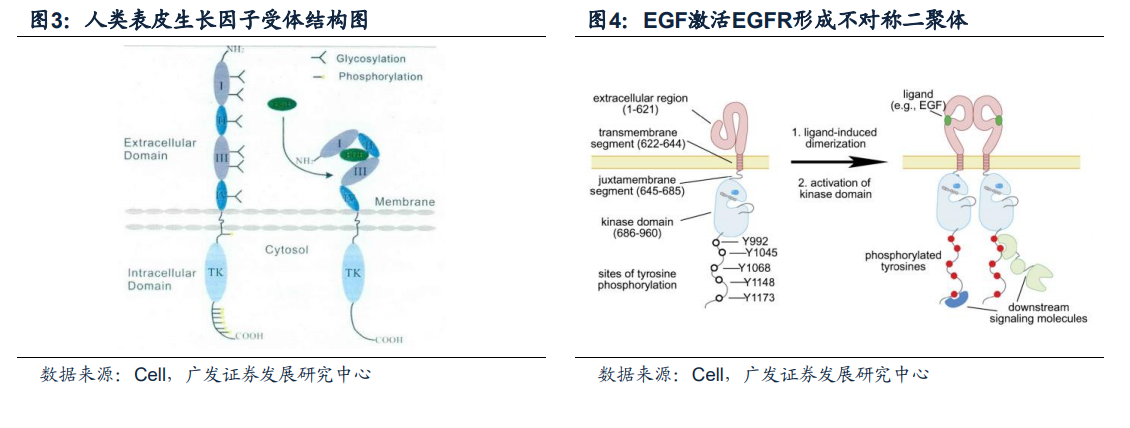
EGFR(epidermal growth factor receptor)中文名稱為表皮生長因子受體,是一種跨膜酪氨酸激酶受體蛋白,是ErbBs家族中的重要成員之一。ErbBs受體酪氨酸激酶家族成員包括ErbB1、ErbB2、ErbB3以及ErbB4。EGFR又被稱為ErbB-1或HER1,是原癌基因c-ErbB1的表達產物。它是一個由1186個氨基酸殘基組成的跨膜糖蛋白,分子量為170kDa。像所有RTKs一樣,從N末端到C末端主要是由三個部分結構組成:胞外區(EC)、跨膜區(TM)、胞內區(KD)。EGFR的胞外區可以進一步分為四個子域分別為I,II,III,和IV區。EGFR的胞外區和配體的復合物晶體結構研究表明I,II和III區形成一個口袋,配體可以結合到這個口袋中。