通常而言,藥物研發可以分為四個典型的環節,即臨床前階段、臨床階段、NDA 審核階段以及藥物生產上市階段。臨床前試驗在動物身上進行,一般耗時 3年左右,而在動物實驗取得較好的結果后,醫藥企業可以提出研究性新藥申請(IND);IND獲得通過后,藥物研發將進入臨床試驗階段,臨床實驗分為三期,每期試驗范圍會逐步擴大,醫藥企業通常會選擇與 CRO(合同研究組織)合作進行臨床實驗,這一步驟通常耗時最久(3-6 年)、投入最大(占研發投入的 50%),如果實驗結果比較滿意,醫藥企業需要向 FDA 遞交新藥申請 (NDA);NDA 通常長達數千頁,涵蓋了整個藥物研發階段的所有實驗過程、實驗成果、相關協議等,而 FDA 則需要通過詳細地審核,確保該藥物的好處大于其副作用,這一步驟通常需要 6-12 個月的時間;在 NDA 審核通過后,藥物可以進入生產及銷售環節,但仍需對大于 2000 人的測試群體進行上市后的開放試驗。在整個研發過程中,會涉及到紛繁復雜的文件與數據,以及跨部門的溝通與協作,醫藥企業需要從源頭確保各個環節數據、內容的真實一致性,保證各個部門信息的充分交互,并滿足監管機構的合規要求,這也就產生了對于藥物研發環節內容&數據管理、質量控制等需求。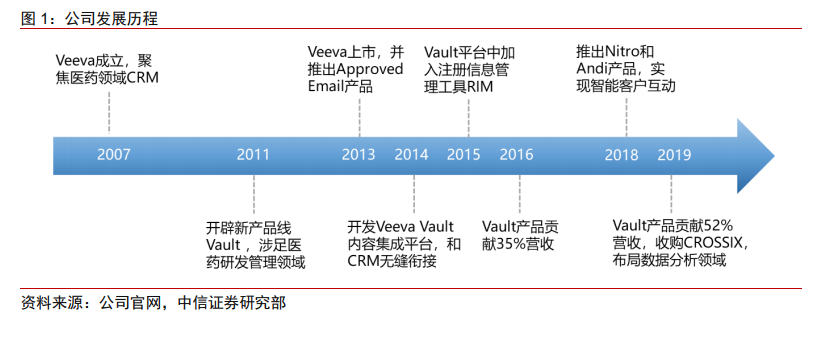
在銷售環節,醫藥企業和其他大多數行業并不相同。醫藥銷售代表面向的客戶是醫生,他并沒有和醫生達成交易,只是試圖說服醫生把公司的產品開給病人,而病人再按照處方購買藥物。為了保證醫生開具處方的公正性,美國醫生薪酬陽光法案規定,必須跟蹤銷售代表與醫生之間的任何書面通信以及財務往來。基于監管要求以及行業本身的特點,Veeva 基于 Salesforce PaaS 平臺開發了針對醫療領域的 CRM 產品Commercial platform。
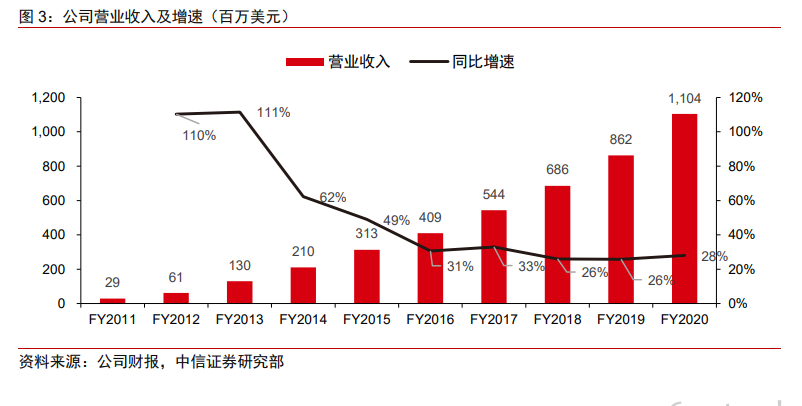
公司業務對應市場空間(TAM):根據公司測算,2019 年公司旗下產品對應的潛在市場空間(TAM)大約在 100 億美元左右。其中,生命科學領域 Veeva Vault 產品的 TAM 為50 億美元,非生命科學領域(包括食品飲料、化學制品、化妝品等)Veeva Vault 產品的TAM 為 10 億美元,Commercial Cloud 產品的 TAM 為 30 億美元,數據分析產品(圍繞公司 2019 年收購的 Crossix 開展)的 TAM 為 10 億美元。當然上述的分析更多是靜態的測算,考慮到生命科學領域企業持續上云需求,以及數字化轉型需求拉動,公司所對應的TAM 亦有持續拓展的可能。